原子量(元素の相対質量のこと)
原子の重さは、「質量数」で表現してきたが、これは正確ではない。
その理由は、陽子と中性子の重さが正確に1:1ではなく、電子の重さも無視しているため。
そこで、原子の重さは、「質量数12の炭素原子1個の質量を12」と決めて、これを基準にして他の原子の重さも表現するようにした。
これを相対質量という。
では、炭素が12に対して水素の相対質量は?
水素原子にはいつくか種類があって、一概に炭素と比較できない。
1H(軽水素:中性子が1つ) 2H(重水素:中性子が2つ) 3H(三重水素水素:中性子が3つ)…などの同位体が存在する。
いくつかある同位体の相対質量の平均値の重さを求めて、その平均値=水素元素をひとまとまりにした重さ(原子量)と考える。
【平均の出し方の確認】
10人クラスで、クラスの80%が同じ体重50㎏、クラスの20%が同じ体重60㎏だったとする。
このクラスの平均の体重は何㎏か。
解答表示
割合×体重+割合×体重=平均
0.8×50+0.2×60
=40+12
=52
*「10人」というヒントは使わずに求められるのが重要。
別解
8人が50㎏、2人が60㎏なので、
8×50+2×60=520
520÷10=52
原子量を求める問題
原子量 = (同位体①の相対質量 × 同位体①の存在比) + (同位体②の相対質量 × 同位体②の存在比)… 同位体の数だけ計算
解答表示
解答表示
分子量と式量
★どちらを使うか?
分子量を使うもの…酸素やアンモニアなど分子を単位とする物質。
式量を使うもの…塩化ナトリウムや酸化銀などのイオンから成る化合物、金属、共有結合結晶などの組成式で表す物質。
式量か分子量か
式量ではなく、分子量を使うのが適当なものを次から選べ。
① 銅
② 酸化銅
③ ダイヤモンド
④ アンモニア
解答表示
解説
① 銅:金属なので、組成式Cuで表されるので、式量を使う。
② 酸化銅:Cu+とO2-のイオンからなるため式量を使う。
③ ダイヤモンド:共有結合の結晶で、組成式Cで表され、式量を使う。
物質量
物質量とは、単位㏖を使う物質の量をさす。
原子や分子のカタマリの数は、多いので単位を定めたのである。
★アボガドロ定数
原子量(分子量・式量)が 1㏖ 集まると g をつけられる数を設定した。
それが、12C= 12 g中に含まれる炭素原子の数であり、6.02 × 1023個の集まりを 1 mol とした。
つまり、原子量 × 1㏖ = 原子量g(モル質量) と表されるようになった。
1㏖ = 6.02 × 1023個 = 22.4L(標準状態)
モル質量=1㏖あたりの質量のこと。
原子量 × 1㏖ = 原子量g
モル体積:1㏖あたりの体積のこと。
22.4L × 1㏖ = 22.4L
*10の23乗を、日本の単位で読むと「1000垓(がい)」となる。
【相対質量(原子量)の暗記】
原子量は、問題文に書いてあることが多い。
しかし、暗記するとスピードアップにつながる。積極的に暗記しよう。
単位変換と物質量計算
【モル計算:molからgへ変換】
二酸化炭素CO2の1モル分は、何gか。
なお、炭素Cの原子量は12、酸素の原子量は16とする。
二酸化炭素CO2の分子量は、12+16+16=44
よって、44グラム
【モルの計算問題:molからgへ変換】
アンモニアが、3molのとき、この質量は何gになるか。
なお、原子量はH:1 N:14 とする。
式 原子量×モル=質量 に当てはめればよい。
アンモニアの分子量
NH31 = 14+1+1+1=17
3㏖分なので、×3をすると、
17×3=51
51g
【モルの計算問題:molから個数へ変換】
炭素24gに含まれる炭素原子は、何個か。
なお、炭素Cの原子量は12とする。
なお、炭素Cの原子量は12とする。
よって、1.2 × 1024
【モルの計算問題:molから個数へ変換】
原子量は、N=14、H=2とする。
質量数14の窒素原子と質量数 2 の水素原子のみからなるアンモニア40.0 gに含まれる中性子は何個か。
なお、アボガドロ定数を6.0 × 1023とする。
アンモニア(NH3)の相対質量(分子量)は、14+2+2+2=20
式に当てはめて、
式 相対質量(分子量)×モル=質量
20×xモル=40g
xモル=2
2㏖分のアンモニア分子の数は、
6.0 × 1023×2= 1.2 × 1024
アンモニア分子1個につき、何個の中性子があるかを考えると、
Nの原子番号は7なので、質量数14-陽子数7=中性子数7
Hの原子番号は1なので、質量数2-陽子数1=中性子数1
よって、アンモニア分子1個につき、7+1+1+1=10個の中性子がある。
つまり、アンモニア分子の数 ×10をすれば、アンモニア分子に含まれる中性子の数が求まる。
よって、1.2 × 1025
【モルの計算問題:molからℓへ変換】
二酸化炭素CO2の1モル分の標準状態の気体の体積は、何ℓになるか。
なお、炭素Cの原子量は12、酸素の原子量は16とする。
*原子量のヒントは使わない。
解説
固体だと結びつき度合いによるため一定ではないが、気体だと結びつきがないため、1モル分と決めるとどんな分子(二酸化炭素、窒素、塩素など)でも体積が一定(22.4ℓ)となる。
濃度
濃度計算の流れ(基本:溶質のgを求め、gが分かればモルもわかるので、モルの方程式を立てる)
溶液の密度g/cm3 → 溶液の密度×体積=溶液のgがわかる。
溶液のg → 溶液のg×質量%濃度=溶質のg
★水の場合のみ、体積と質量が一致する。
例:水100mlであれば、100gとなる。
★体積の単位は、ml=cm3をよく使う。
食塩水100mlは、100gとはならず、体積と質量は異なる。
例題【濃度の計算問題】
食塩水の密度が1.1g/cm3、質量パーセント濃度が5%のとき、この食塩水100ml中に含まれる食塩は、何gになるか。
解答表示
食塩水の体積が100mlだと、食塩水の質量は、110gとなる。←密度のヒントより
食塩水の質量110gのうち、食塩の質量は5%なので、5.5gとなる(答え)。
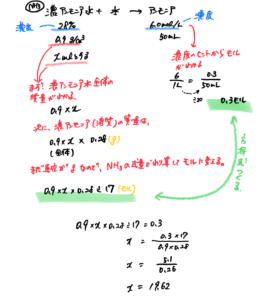
【濃度の計算問題:濃度をうすめる希釈パターン】
濃アンモニア水を水で希釈して、6.0 mol/Lのアンモニア水50 mLをつくりたい。
必要な濃アンモニア水は何mLか。
ただし、濃アンモニア水は質量パーセント濃度が28%、密度が0.90 g/cm3である。
原子量はH:1,N:14 とする。
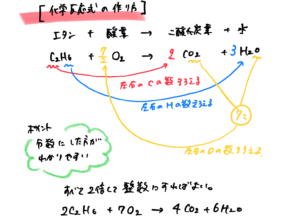
化学反応式
★反応物+反応物→生成物
★反応式の係数が粒の数を示し、左右で粒の数が異なる(モルが異なる)点に注意
2H2 + O2 → 2H2O
2粒 + 1粒 → 2粒
2モル + 1モル → 2モル
【化学反応式の計算問題1】
ある質量の黒鉛C に、標準状態で3.36Lを占める酸素O2を加えて燃焼させた。
黒鉛と酸素はともにすべて反応して、完全燃焼した二酸化炭素CO2と、不完全燃焼による一酸化炭素CO、のみからなる混合気体が標準状態で5.60L生成した。
生じた混合気体中の二酸化炭素と一酸化炭素の物質量の比(CO:CO2)を計算しなさい。
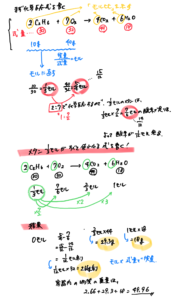
【化学反応式の計算問題2】
エタンC2H6 10.0gを40.0gの酸素とともに,密閉した容器で完全燃焼させた。反応が完全に終了した時の、容器内のすべての物質の重量を合計すると,何gになるか。
練習プリント
テストで90点以上が取れるコツ
1、学校のワーク(問題集)をテスト1週間前までに解き終わり基本を身につける。
2、定期テスト過去問を解く。
3、入試問題(正答率20%以下)を解く。
定期テスト過去問を解くだけでも、十分な得点を狙えます。
しかし、満点を狙いたい方へ。
学校の先生によっては、100点を防ぐために、入試問題まで出題される方がいらっしゃいます。
受験ガチ勢チートでは、受験のプロが完全無料で、入試問題を丁寧にわかりやすく解説しています。
是非、チャンネル登録をお願いいたします↓↓
-120x120.jpg)
.jpg)
.png)
.jpg)


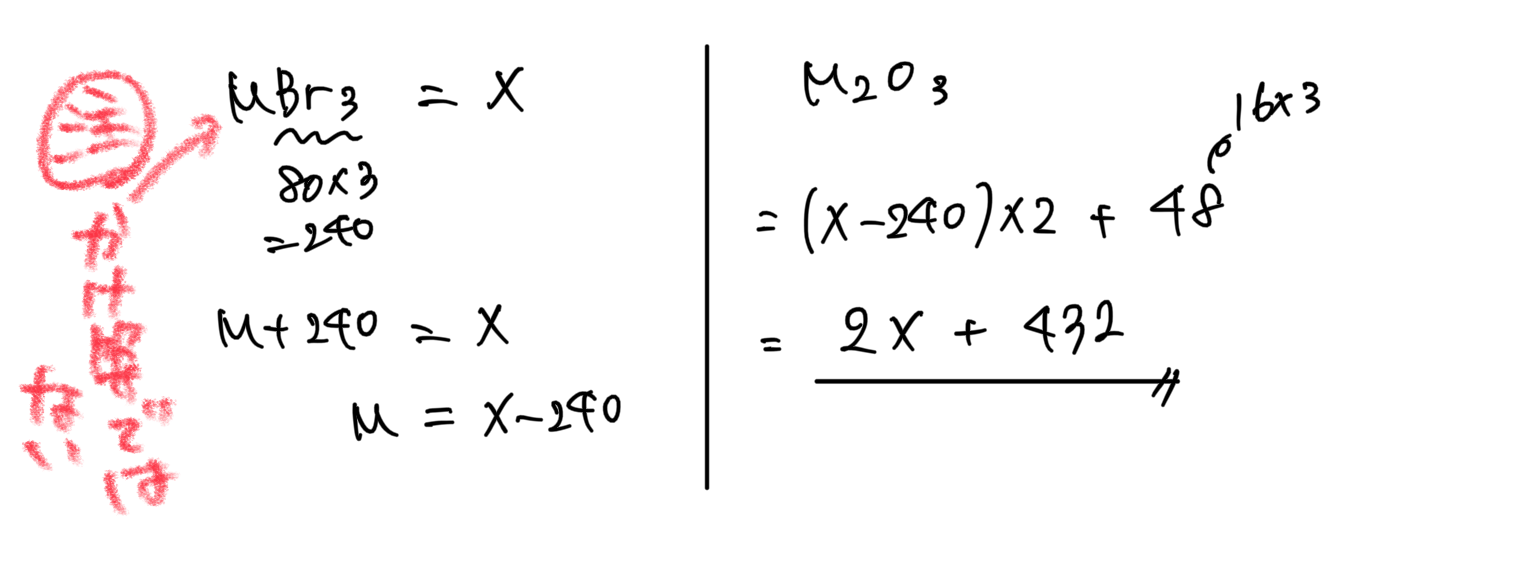
.jpg)
.jpg)

.jpg)
解答.jpg)