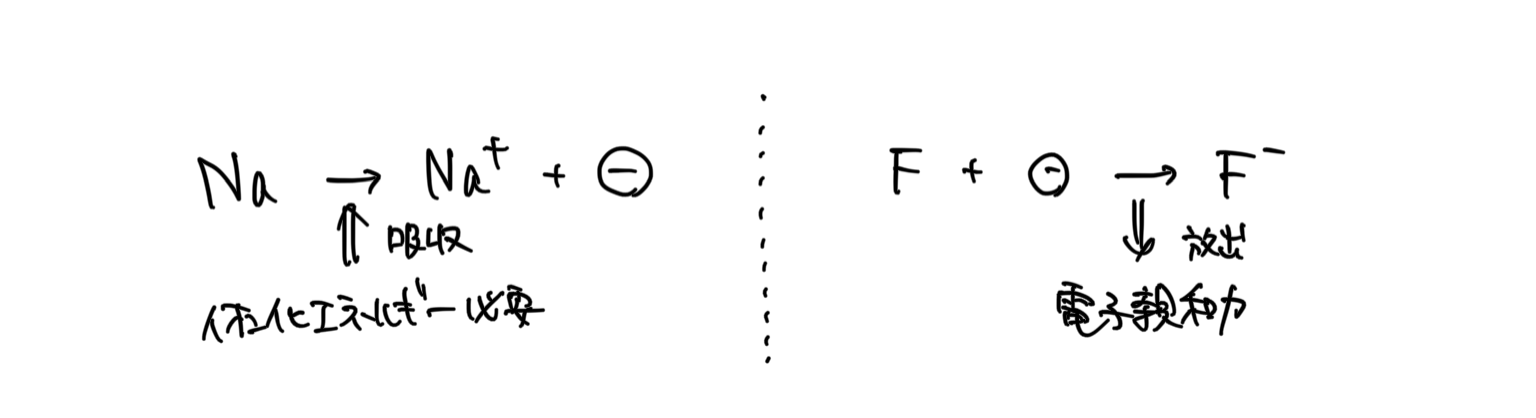次の単元へ
化学基礎②《物質と化学結合》/
【第1編】物質の構成と化学結合
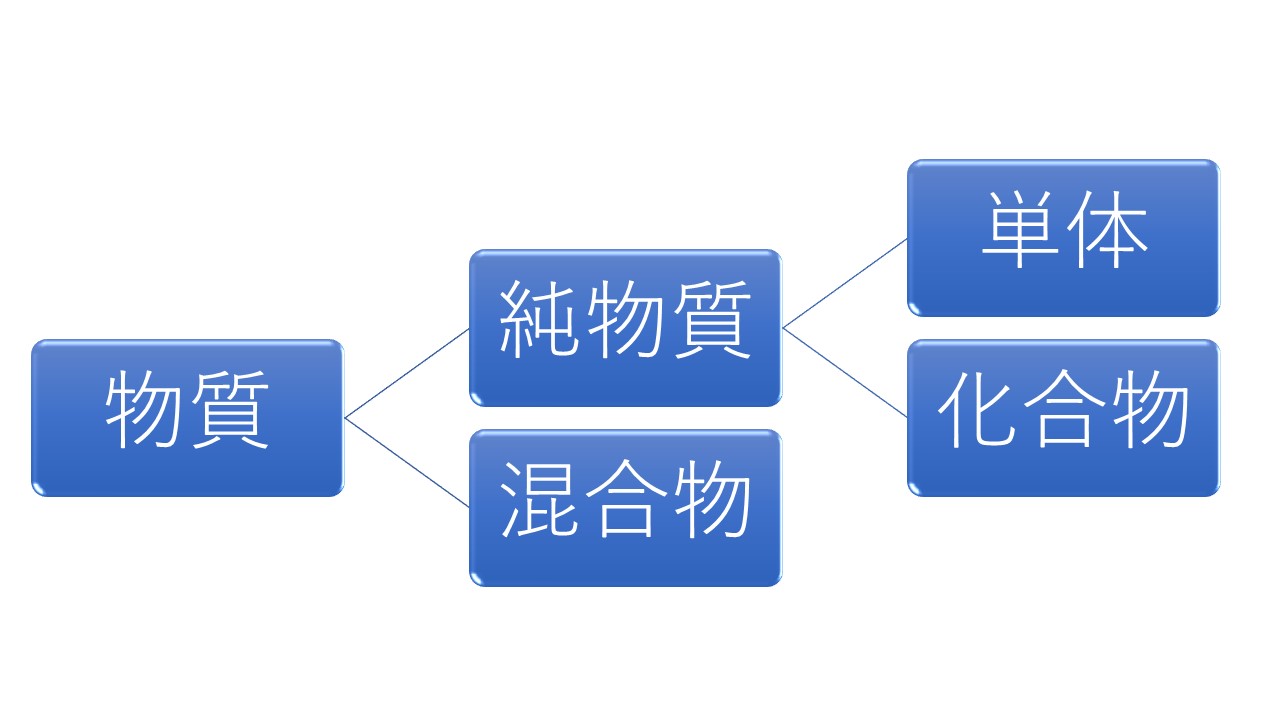
物質の分類
単体について(まずは元素記号の暗記からスタート)
解説・ポイント
単体とは:元素記号を1種類だけ使って表現できる物質のこと。
例
金属《銅Cu アルミニウムAl》
分子《水素H2 窒素N2 酸素O2 オゾンO3 フッ素F2 塩素Cl2 臭素Br2 ヨウ素I2》
同素体《酸素O2 オゾンO3 ダイヤモンドC、黒鉛(グラファイト)C、フラーレンC60》など。
暗記問題・演習
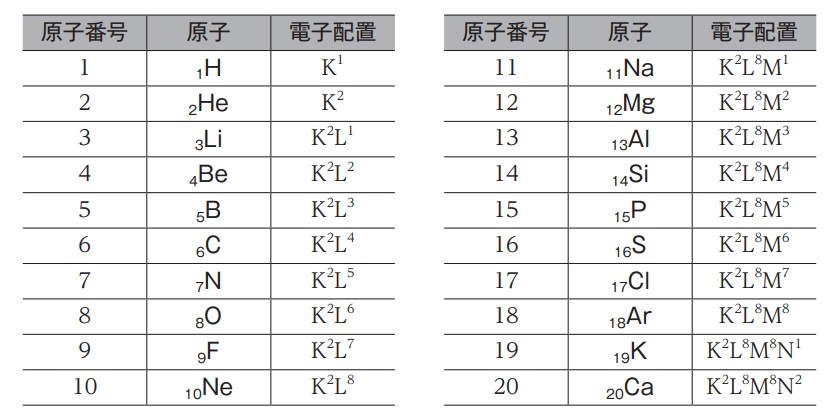
原子番号から元素名を答えましょう。
*元素名から原子番号もすらすら言えるようにしましょう!
18
2
17
5
4
3
19
14
10
13
20
12
15
9
11
7
8
6
1
16
単体、化合物、混合物を選ばせる
解説・ポイント
化合物とは、2種類以上の元素が結合している物質のこと。
例 水H2O プロパンC3H8 メタンCH4 石英(二酸化ケイ素)SiO2 アンモニアNH3 二酸化炭素CO2 硫酸H2SO4
【覚えるしかない】化学基礎で出てくる化合物一覧(112個)プリント
★化合物は、化学反応によって単体に分けることができる。*物理的な方法では分離不可能。
例 水 → 酸素+水素
混合物とは、2種類以上の純物質(単体、化合物)から成り立っている物質のこと。
例 空気、濃硫酸(水+H2SO4)、塩酸(塩化水素と水)、砂糖水、海水、水溶性インク、お茶、食塩と砂が混ざったもの、ヨウ素と砂の混合物、硝酸カリウムと塩化ナトリウムの混合物、酢酸エチルとジエチルエーテルが混ざったものなど。
★混合物は、物理的な方法(ろ過、蒸留、分留、昇華、再結晶、クロマトグラフィー、抽出など)によって純物資(単体、化合物)へ分離することができる。
例 海水 → 加熱して、水だけを取り出せる《蒸留》
暗記問題・演習
次の物質は、単体、化合物、混合物どれにあたるか答えなさい。
*単体と化合物は、化学式を覚えてしまいましょう。
塩化ナトリウム
塩酸
アルゴン
プロパン
臭素
一酸化炭素
塩化ナトリウム
ダイヤモンド
オゾン
灯油
メタン
メタンCH4
アンモニア水
*アンモニアだけならNH3で化合物
希硫酸
*硫酸だけならH2SO4で化合物
石英
石英(二酸化ケイ素)SiO2
単体と元素の違い
解説・ポイント
元素の組み合わせ → 物質(実際に存在している)
単体名と元素名は同じ表記が多いが、使われている意味が違う。
・元素としての「酸素」の意味 → そもそも元素とは物質を構成する成分のことなので、必ず他の元素と化合している場合を意味している。
・単体としての「酸素」の意味 → 単独で自然界に存在している物自体を指し、実際に触れることができるという意味を持つ。
余談:表記が同じだが意味が違う「バカ」
・(彼女がテストで0点を取った)0点取るなんて「バカ」だね 意味:文字通りの意味
・(彼女が泣いている)ほんと「バカ」だなぁ、泣く必要なんてないのに。 意味:文字通りではなく、応援の意味で言っている
例 酸素
・生物は呼吸によって、「酸素」を取り込んでいる。 →実際に存在している酸素を吸っているので、単体としての意味
・空気中に「酸素」は、約20%含まれる。 →空気中で実際に触れることができるので、単体としての意味
・水の電気分解により、水素と「酸素」が得られる。 →分解されることで単独でこの世に存在しているので、単体の酸素の意味
・酸素とオゾンは、「酸素」の同素体である。 →この場合、実在している酸素の意味はないので、元素としての意味
暗記問題・演習
次の文章内の「 」は、単体としての意味か、元素としての意味か答えなさい。
「アルミニウム」はボーキサイトを原料としてつくられる。
「カルシウム」は歯や骨に多く含まれている。
よって、元素としての意味
アンモニアは「窒素」と水素から合成される。
競技の優勝者に「金」のメダルが与えられた。
地殻の質量でもっとも多いのは「酸素」である。
単体で液体であるもの
解説・ポイント
単体とは:元素記号を1種類だけ使って表現できる物質のこと。
例
金属《銅Cu アルミニウムAl》
分子《水素H2 窒素N2 酸素O2 オゾンO3 フッ素F2 塩素Cl2 臭素Br2 ヨウ素I2》
同素体《酸素O2 オゾンO3 ダイヤモンドC、黒鉛(グラファイト)C、フラーレンC60》など。
単体(実際にこの世に存在する形)の中で、常温・常圧で、液体であるものは2つ《水銀Hg 臭素Br2》しかない。
暗記問題・演習
単体が常温・常圧で気体でない元素を次から選びなさい。
H
N
Br
O
F
Hg
臭素Br
解説
元素Oは、同素体の酸素O2とオゾンO3の2パターンあるがどちらも気体で、単体としてこの世に存在している。
元素の確認方法(炎色反応、沈殿反応、水の生成)
リアカー Li 赤
無き Na 黄
K村 K 赤紫
動力 Cu 青緑
馬力 Ba 黄緑
借りようと Ca 橙赤(とうせき)
するも貸してくれない Sr 紅
★塩化銀(沈殿物)の生成によって、塩素が含まれていたことが確認できる
Ag+ + Cl– → AgCl↓
例 硝酸銀AgNO3 水溶液 + 塩化ナトリウムNaCl → 硝酸ナトリウムNaNO3 + 塩化銀AgCl↓
★炭酸カルシム(沈殿物)の生成によって、炭素・酸素が含まれていたことが確認できる
水酸化カルシウム水溶液Ca(OH)₂ + 二酸化炭素CO₂ → 炭酸カルシウムCaCO₃↓ + 水H₂O
★水の生成によって、酸素・水素をが含まれていたことが確認できる
白色の硫酸銅Ⅱ CuSO4 + 水H2O = 青色の硫酸銅Ⅱ五水和物CuSO4•5H2O
混合物から純物質を取り出す《分離・精製》
解説・ポイント
分離とは、物質の性質の違いを利用して、混合物から目的の純物質をとり出す操作のこと。
精製とは、分離した物質から不純物をとり除いて、純度をより高くする操作のこと。
分離・精製の方法として、ろ過、蒸留、分留、昇華、再結晶、クロマトグラフィー、抽出などがある。
★ろ過:粒子の大きさの違いを利用
砂が混じった塩化ナトリウム水溶液から,砂を取り除く実験
★蒸留:沸点の違いを利用
海水から水だけを取り出す場合の実験
★分留(分別蒸留):2 種類以上の液体混合物を蒸留によって分離
原油( 石油) からガソリンや灯油などを取り出す
★再結晶:温度による溶解度( 物質が100g の水に溶ける量) の変化の違いを利用
少量の塩化ナトリウムが混ざった硝酸カリウムから硝酸カリウムを取り出す実験
★昇華法:昇華性の有無の違いを利用
ヨウ素と鉄の混合物を加熱して、ヨウ素を取り出す実験
*昇華性をもつ物質にはヨウ素I2 ナフタレンC10H8 ドライアイスCO2 など
★ペーパークロマトグラフィー:吸着力の違いを利用
黒インクからさまざまな色素を取り出す実験
★抽出:溶媒に対する溶解度の違いを利用
ヨウ素ヨウ化カリウム(ヨウ素+ヨウ化カリウム)の水溶液からヨウ素を取り出す実験
暗記問題・演習
次の記述が正しければ〇、間違っていれば✕とその理由も答えなさい。
溶媒に対する溶けやすさの差を利用して混合物から特定の物質を溶媒に溶かして分離する操作を抽出という。
沸点の差を利用して、液体の混合物から成分を分離する操作を昇華法(昇華)という。
蒸留(分留)についての記述だから
不純物を含む固体を溶媒に溶かし、温度によって溶解度が異なることを利用して、より純粋な物質を析出させ分離する操作をろ過という。
再結晶についての記述だから
固体の混合物を加熱して固体から直接気体になる成分を冷却して分離する操作を蒸留という。
昇華についての記述だから
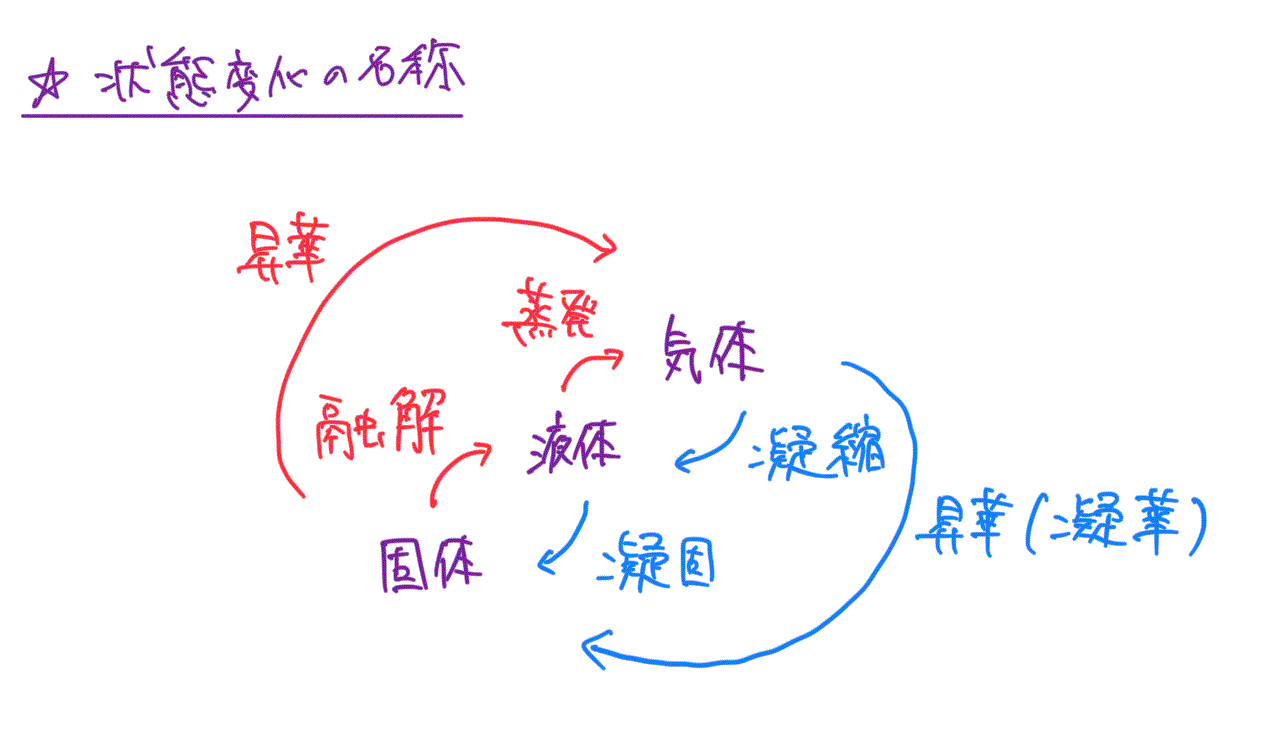
状態変化の名称
解説・ポイント
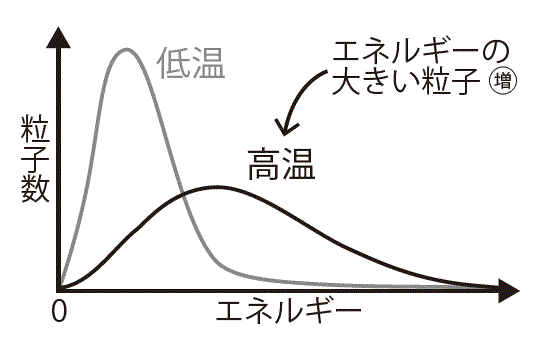
気体の運動エネルギー
温度を高くすると,運動する速さの大きい粒子の割合が増える。
絶対温度(K:ケルビン)
27℃を、絶対温度(K)で表せ。
絶対零度(気体の熱運動が完全に停止する温度)のセルシウス温度は?
*絶対温度で表すと、0K
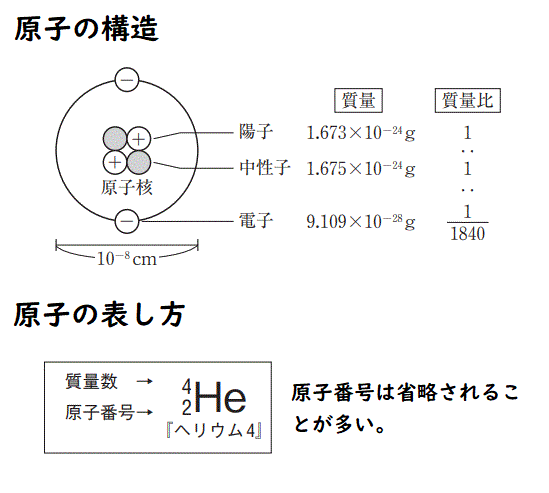
物質を構成する粒子
原子の構造
原子の化学的性質を決めるのは陽子である。
陽子、中性子、電子の中で最も重要な陽子の数は、そのまま原子番号となっている。
★原子の重さの単位「質量数」について
グラムで表すのではなく、粒の数で表すことにした。
陽子、中性子、電子の3つの質量比的に、電子の粒の数は考えないものとする。
よって、質量数=陽子の数+中性子の数
「質量数」とは何か。
同位体(アイソトープ)について
同位体の中でも、原子核が不安定で、放射線を出しながら原子核が壊れていくものを放射性同位体(ラジオアイソトープ)という。
さらに、放射性同位体の中でも、原子核の壊れ方によって、①α壊変と、②β壊変の2つに分かれる。
①α壊変とは、陽子の数と中性子の数が2つずつ(ヘリウムの原子核)が出ていく(α線を出す)壊れ方のこと。
②β壊変とは、中性子が陽子と電子に変化し、電子が出ていく壊れ方のこと。電子が出ていく(β線を出す)だけなので、質量数は変化なし。
壊変によって、放射性同位体の原子数が半分になる時間を半減期という。
2の累乗で考えていけばよい。
「同位体」とは何か。
ある患者に治療のためSrを40.0mg投与した。体内からSrは排出されないものとして,投与後,体内に残っているSrが2.50mgになるのに要する日数を求めよ。
ただし,Srの半減期を50.5日とする。
$ (\frac{1}{2})^x = \frac{1}{16} $
$ x=4 $
つまり、半分を4回繰り返すと、40.0mgが2.50mgになる。
よって、50.5×4=202日
天然の水素には 1H,2H の 2 種類の安定な同位体が,天然の酸素には 16O,17O,18Oの 3 種類の安定な同位体がそれぞれ存在する。このとき,天然に存在する H2O 分子には,質量の異なるものが何種類存在すると考えられるか。
解説
16O 1H 1H
16O 1H 2H
16O 2H 2H
これが、17O,18Oの場合もあるから、3×3=9通り
電子配置・イオン・イオン化エネルギー
原子の電子配置
閉殻とは、電子殻に最大収容数である $ 2n^2 $ 個の電子が入った状態のことをいう。
★オクテット
しかし、実際に入る電子数は、8個の場合が多い。
つまり、最外殻電子は8個(オクテットの状態:希ガス)が多い。
なぜなら、電子が安定する数が8だから。
*1オクテット(octet)は、8ビットを表す。
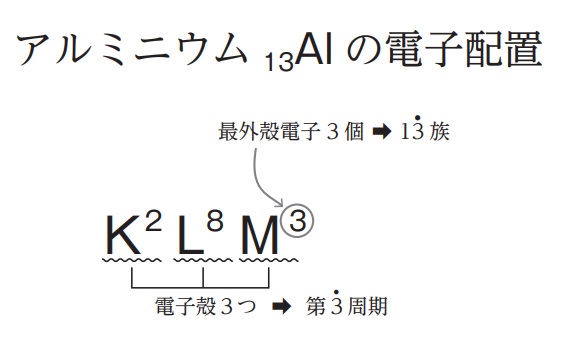
カルシウムの電子配置を書き、周期と族も答えなさい。
→ K2L8M8N2
→ 周期は、KLMNの4周期
→ 族は、最外殻電子が2なので、2族
価電子
最外殻電子は、結合に関与する電子なので、別名:価電子(価値ある電子の意)ともいう。
例 最外殻電子が3≒価電子も3
(例外:最外殻電子が8=価電子0 ∵ 安定してもうくっつかないため。)
*イオンの価電子は必ず0。なぜなら、オクテットの状態だから。
★価電子(最外殻電子)の計算方法
まず原子番号をイメージ
電子配置 KLMN を考えて、最外殻電子を求める(原子番号から-2-8-8…していく*)
*希ガスの原子番号だけ引き算をする(例 フッ素 F → 9-2(He)=7 、ケイ素 Si → 14-10(Ar)=4 )
(別解)10番台なら、Ar(10)を引き算するので、原子番号の1桁目がそのまま価電子となる。
次の原子の価電子の数はいくつになるか。
酸素
→電子配置 K2L6
→最外殻電子が6個なので、価電子も6
アルゴン
→電子配置 K2L8M8
→最外殻電子が8個(オクテッド)なので、価電子は0
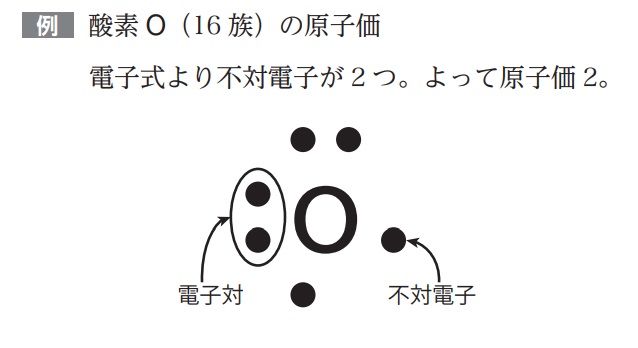
電子式と原子価(不対電子)
価電子を4方向(上下左右2マスずつ)に表記していく式のこと。電子の結合をイメージするために使う。
「・」の位置は厳密に定められておらず、必要に応じて点の位置を変えてよい。だいたい上下左右にバラバラに電子を入れていく。
★電子式の原子価
原子価とは、ほかの元素の原子と結合する能力を表す数のこと。不対電子の数と同じになる。
不対電子とは、上下左右2個ずつ(オクテット)のマスの中で、1マスだけの電子のこと。
★原子価の計算方法
最外殻電子(価電子)をまず求める
最外殻電子について、上下左右2個ずつ(オクテット)のマスの中で、1マスだけの電子をイメージして答えればよい
炭素の原子価を答えなさい。
電子配置 K2 L4
最外殻電子(価電子)は4
原子価(不対電子対)は上下左右2個ずつ(オクテット)のマスをイメージして、1マスだけの電子は4
リン酸の原子価を答えなさい。
電子配置 K2 L8 M5
価電子(最外殻電子) 5 *原子番号の1桁
原子価(不対電子対)は上下左右2個ずつ(オクテット)のマスをイメージして、1マスだけの電子は3
イオンとは
*イオンは必ずオクテットの状態なので、価電子(最外殻電子)は0になる。
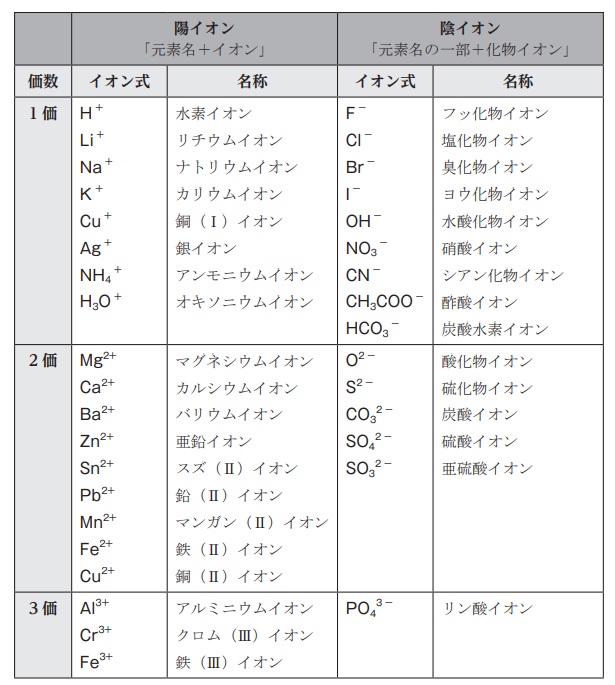
★イオンの名前の付け方
単原子イオン:1 種類の原子からなるイオン。
陽イオンの名前は「元素名+イオン」で作ることができる。例 Na+ ナトリウムイオン
陰イオンの名前は「元素名の一部+化物イオン」で作ることができる。例 F— フッ化物イオン
多原子イオン(2 種類以上の原子からなるイオン)は、覚えるしかない。
暗記しておくべきイオン《ランダムテスト》
オキソニウムイオン
炭酸イオン
臭化物イオン
炭酸水素イオン
ヨウ化物イオン
スズ(Ⅱ)イオン
硫化物イオン
亜硫酸イオン
硫酸イオン
カリウムイオン
シアン化物イオン
アルミニウムイオン
バリウムイオン
フッ化物イオン
硝酸イオン
リン酸イオン
アンモニウムイオン
酸化物イオン
カルシウムイオン
クロム(Ⅲ)イオン
鉛(Ⅱ)イオン
酢酸イオン
マンガン(Ⅱ)イオン
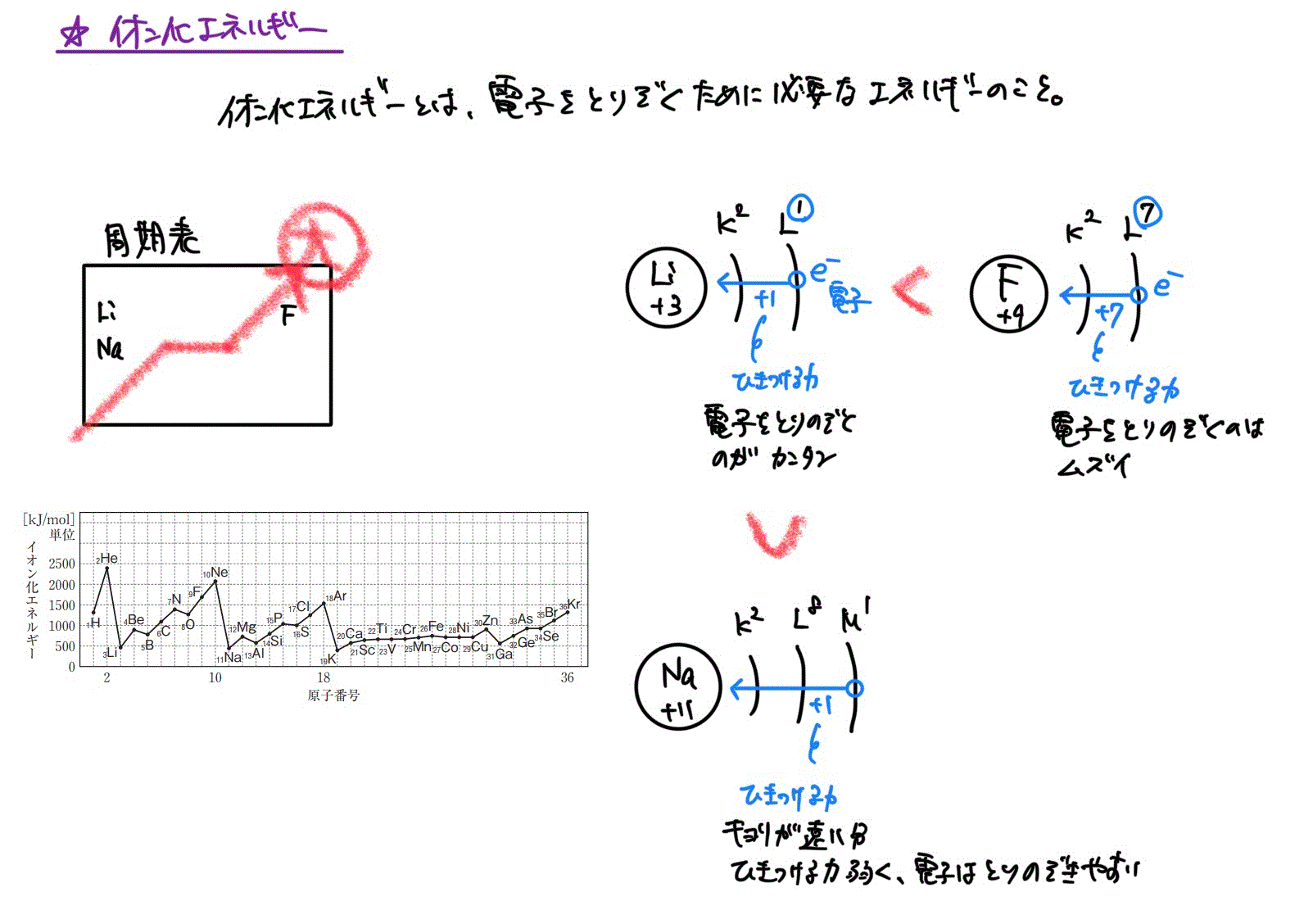
イオン化エネルギーと電子親和力
原子から電子を取り去るためにエネルギーが必要。なぜなら、陽子が電子をひきつけているため引力に逆らうためにはエネルギーが必要だから。
この電子を取り去るために必要なエネルギーのことをイオン化エネルギーという。
定義より、イオン化エネルギーが小さいほど、電子を取り除きやすく陽イオンになりやすいといえる。
*1つの電子を取り去るエネルギーを第一イオン化エネルギーという。
2つの電子を取り去るエネルギーを第二イオン化エネルギーという。
★電子親和力とは
原子はオクテットの安定した状態になりたいがために、エネルギーを支払ってでも電子を手に入れたい(植物が虫を寄せ付けるために出す蜜みたいな感じ)。
この電子を手に入れるために放出されるエネルギーを電子親和力という。
定義より、電子親和力が大きいほど電子をひきつけることができ、陰イオンになりやすい。
*電子親和力は、電子をひきつけるだけなので、イオン化エネルギーよりも小さい。
イオン化エネルギーが1番大きい原子と、2番目に大きい原子を答えましょう。
2番 O 酸素
*周期表の右上
【〇✕問題】リチウムイオンとヘリウム原子は電子配置が同じである。
【〇✕問題】塩化物イオンの価電子の数は 7 個である。
【〇✕問題】原子が 1 価の陽イオンになるときに吸収するエネルギーをイオン化エネルギーという。
【〇✕問題】原子が 1 価の陰イオンになるときに必要なエネルギーを電子親和力という。
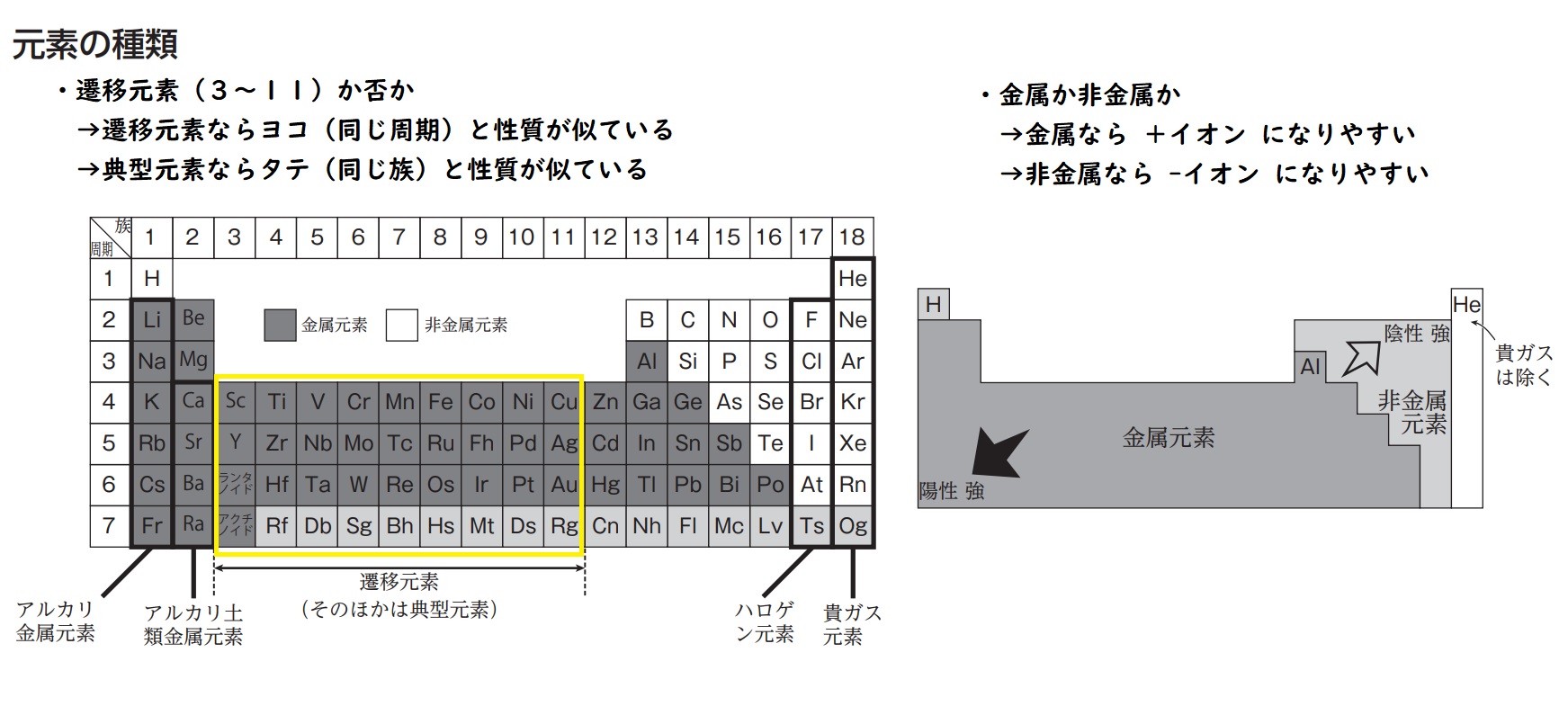
元素の周期表
現在の周期表は、元素を原子番号順に並べ,性質の似たものを縦に配列したもの。
昔、メンデレーエフがつくった周期表は、原子量順に並べたもので、性質のよく似た元素が一定の間隔であらわれること(元素の周期律)を発見した。
テストで90点以上が取れるコツ
1、学校のワーク(問題集)をテスト1週間前までに解き終わり基本を身につける。
2、定期テスト過去問を解く。
3、入試問題(正答率20%以下)を解く。
定期テスト過去問を解くだけでも、十分な得点を狙えます。
しかし、満点を狙いたい方へ。
学校の先生によっては、100点を防ぐために、入試問題まで出題される方がいらっしゃいます。
受験ガチ勢チートでは、受験のプロが完全無料で、入試問題を丁寧にわかりやすく解説しています。
是非、チャンネル登録をお願いいたします↓↓
-120x120.jpg)
.jpg)
.jpg)
.jpg)
と実際の最外殻電子(オクテット)の違い.jpg)