【大学入試】化学基礎~目次一覧~
1,物質の構成と化学結合
A 物質の構成
B 物質の構成粒子
C 粒子の結合
2,物質の変化
A 物質量と化学反応式
B 酸と塩基の反応
C 酸化還元反応、電池と電気分触 ⇒現在はここのページ
【大学入試】化学基礎⑤《酸化還元反応》》重要語句と典型問題まとめ・総チェック
酸化・還元とは
※酸素とくっつく、くっつかないで覚えると訳がわからなくなるため、電子を基準に覚えると良い。
還元とは、電子をもらう(電荷がマイナスになる)こと。
※ポイント還元みたいなイメージ。
酸化とは、電子を放出する(電荷がプラスになる)こと。
※酸素がなくても、定義上、酸化は起こる。
酸化数とは
実質的な電荷のこと。
例 酸化数+3
=電子を3つ放出して、プラス3を意味している。
例 酸化数➖3
=電子を3つもらって、マイナス3を意味している。
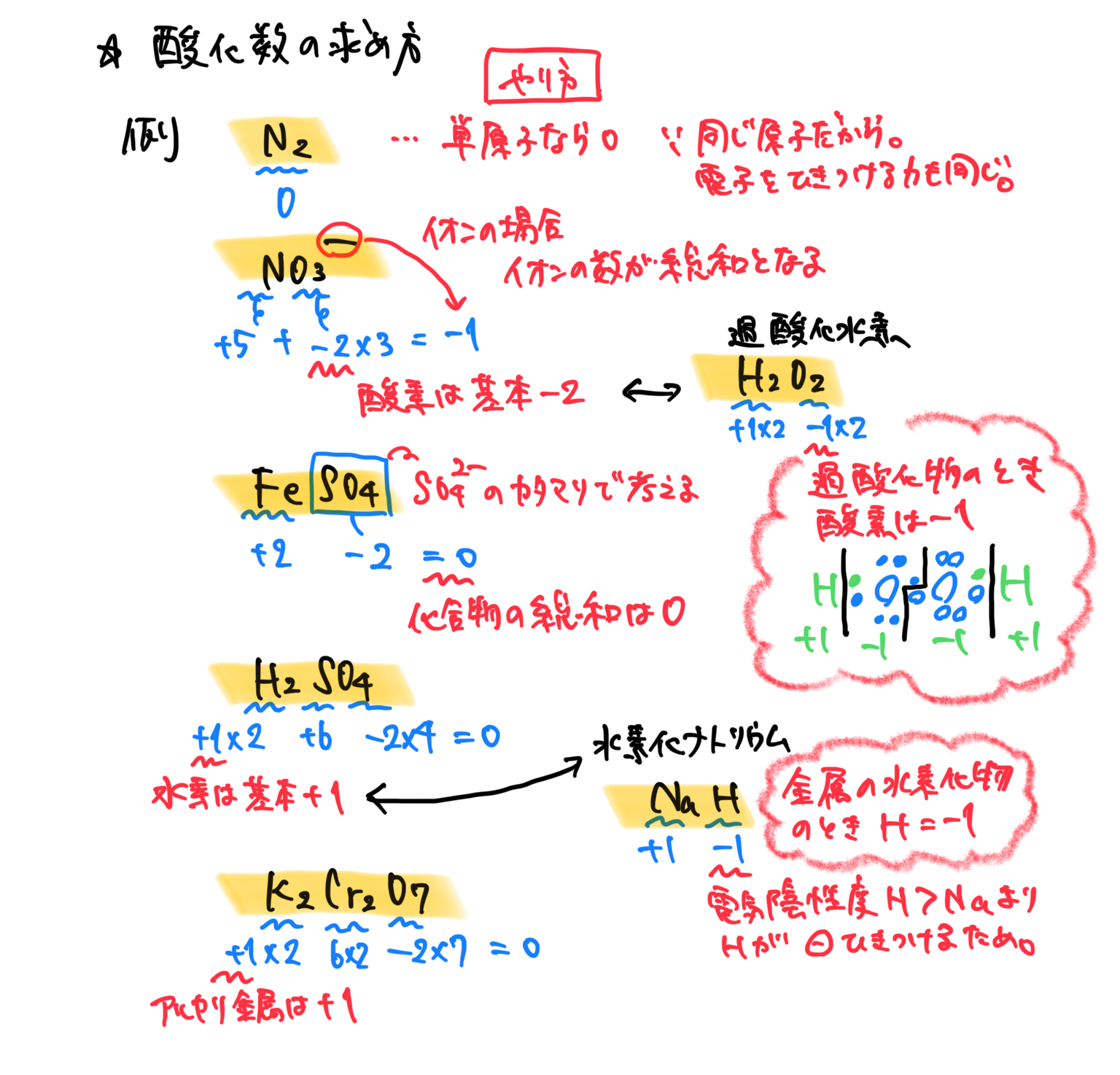
酸化数の求め方
根本的な考え方は、共有電子対を引きつける電子親和力を考えていく。
しかし、いちいち図を書いてそれを求めるのは時間がかかるので
やり方を覚えてしまう。
まず水素があったら+1
ただし、金属と一緒のときは➖1
酸素があったら➖2
ただし、同じ酸素がいたら➖1
アルカリ金属がいたら+1
2族がいたら+2
ハロゲンがいたら➖1
イオンのカタマリで考える場合もある
還元剤、酸化剤とは
イメージ
売り主→買い主
電子あげる側→電子もらう側
還元剤 酸化剤
酸化剤とは,相手を酸化する物質のことで,自身は還元される。
還元剤とは,相手を還元する物質のことで,自身は酸化される。
⭐️代表的な還元剤と酸化剤を暗記する
まず、どちらとも働くものチェック
過酸化水素 H2O2
二酸化硫黄 SO2
これらは、もし他に還元剤がいるなら自身は酸化剤として働き、酸化剤がいるなら自身は還元剤として働く
還元剤
〜は、〜となって電子を放出する
言葉で覚えるとよい
酸化還元反応とは
酸化還元反応
酸化剤と還元剤の反応(酸化と還元は必ず同時に起こる)。
酸化剤は弱い還元剤へ,還元剤は弱い酸化剤へ変化する。
酸化還元反応の見分け方
①化学反応式の中に単体があるときは酸化還元反応
②知っている酸化剤と還元剤の組み合わせになっているときは酸化還元反応
③左辺と右辺で酸化数の変化があれば酸化還元反応
※1つ1つの元素の酸化数を計算していくので、他の反応(弱酸遊離反応など)であとはまるものがあれば、それと判断
酸化還元反応式のつくり方
①酸化剤と還元剤の半反応式の e -の係数をそろえて両式をたす
②省略されているイオンを追加する
酸化還元滴定とは
酸化還元滴定とは
酸化剤と還元剤の標準溶液を用いて,濃度のわからない還元剤や酸化剤の濃度を求 める操作のこと。
※実験に使用する器具は中和滴定と同じ。ただ、指示薬は使用せず、イオンの色を見て判断。
⭐️濃度の求め方
中和と同じように、
モルで方程式を作れば良い。
ちなみに中和の復習
H+の物質量 = OH-の物質量(モル比1:1)
モルを考えるので価数も関係する。
つまり、
酸の物質量×価数 = 塩基の物質量×価数
となる点で中和し、かかる方程式を立てる。
問題文のヒントとして
酸化還元反応式(化学反応式)が与えられていたら、係数比=モル比なので立てやすい。
もし、酸化還元反応式ではなく、半反応式で与えられていたら、
半反応式を完璧な酸化還元反応式にして係数比を見る必要はなく、
半反応式の電子の係数比=モル比となる。
酸化剤KMnO4 の物質量× 電子の係数5
= 還元剤H2C2O4 の物質量× 電子の係数2
※硫酸があった場合、方程式の中に組み込む必要があるか?
→希硫酸の場合、考慮の必要なし。この場合、硫酸酸性といって、溶液を酸性にするために使用されているだけ。溶液を酸性にさせることで、過マンガン酸カリウムを酸強い酸化剤としてはたらかせている。
例
5.00 × 10 − 2 mol/L のシュウ酸水溶液 10.0mL に,硫酸酸性下で過マンガン酸カリ ウム水溶液を滴下したところ,18.0mL 加えたところで終点となった。
MnO4 -+ 8H++ 5e-→ Mn2 ++ 4H2O
H2C2O4 → 2CO2 + 2H+ + 2e-
過マンガン酸カリウム水溶液の濃度(mol/L)を求めよ。
金属の還元力(電子の放出しやすさ)
金属の還元力(電子の放出しやすさ)=イオン化傾向
イオン化傾向(金属が水溶液中でどのくらい陽イオンになりやすいか)の大きいものほど、イオンになって電子を放出しやすい。
イオン化列
Li K Ca Na Mg Al Zn Fe Ni Sn Pb (H2) Cu Hg Ag Pt Au
リ・ ッ チ に 貸・ そ う か・ な・ 。 ま・ あ・ , あ・ て・ に・ す・ ん な・ 。 ひ・ ど・ す・ ぎ・ る 借・ 金・ 。
⭐️水と反応できる金属
そもそも水自身、電離しにくい。
H2O ⇄ H+ + OH-
この電離しにくく少ないH+ に電子を還元できるのは、イオン化列で最初の方のみ。
Li K Ca Na …冷水と反応
Li K Ca Na Mg …熱水と反応
Li K Ca Na Mg Al Zn Fe …高温水蒸気
Ni Sn Pb (H2) Cu Hg Ag Pt Au…水と反応しない。
⭐️強酸と反応する金属
そもそも酸は溶液中にH+が存在しているので、簡単に電子とくっつけることができる(還元できる)。
※溶液中の水素イオンは電子を受け取り、水素が発生する。
Li K Ca Na Mg Al Zn Fe Ni Sn Pb …希硫酸、塩酸で反応
※ただし Pb は希硫酸と反応して硫酸鉛 PbSO4,塩酸と反応して塩化鉛 PbCl2 の沈殿を 生じるため,すぐに反応が停止する。
Li K Ca Na Mg Al Zn Fe Ni Sn Pb (H2) Cu Hg Ag …強い酸化剤(電子を奪う):熱濃硫酸、希硝酸、濃硫酸などと反応
※Fe,Ni,Al は希硝酸には溶けるが、濃硝酸・熱濃硫酸に浸すと表面に緻密な酸化被膜を形成し,内部 が保護された状態になるため反応が進行しない。この状態を不動態という。
Li K Ca Na Mg Al Zn Fe Ni Sn Pb (H2) Cu Hg Ag Pt Au…王水(硝酸:塩酸=1:3で混ぜ合わせたもの)
⭐️空気中の酸素との反応
そもそも酸素は弱い酸化剤なので、イオン化傾向の大きい金属しか反応しない。
Li K Ca Na …常温で速やかに酸化される
Li K Ca Na Mg Al …加熱により酸化される
Li K Ca Na Mg Al Zn Fe Ni Sn Pb(H2)Cu Hg …強熱により酸化される
金属の腐食とめっき
腐食とは
常温で酸素と反応するのはナトリウムまでだが、時間とともに酸化され,酸化物や水酸化物,炭酸塩などに変化していくこと
めっき
金属の腐食を防ぐために,金属表面を別の金属で覆うこと
ブリキ(鉄の表面をスズでめっきしたもの)
Sn のほうが,イオン化傾向が小さいため,Fe のみと比べて腐食されにくくなる。
しかし,表面に傷がついて Fe が露出すると Sn より Fe が先に腐食されるため,めっき の効果はなくなってしまう。
よって,ブリキは傷がつきにくいところで使用される。
傷がつきやすいところで使用されるのが次のトタン。
トタン(鉄の表面を亜鉛でめっきしたもの)
Fe のほうが,イオン化傾向が小さいが,Zn は表面に酸化被膜を作るため,Fe のみと比べて腐食されにくくなる。
また,表面に傷がついて Fe が露出しても Zn が先に腐食されるため,Fe は腐食されにくい。
酸化還元反応の応用(電池)
電池とは
酸化還元反応によって生じる化学エネルギーを電気エネルギーに変えて取り出す装置のこと。
イオン化傾向の大きい金属が電子を放出するため負極となる。
正確な表現としては、正極の金属も電子を放出しているが、負極の金属の電子放出の差の分だけ相対的に正極の金属が電子を受け取る形となる。
ここで、負極と正極の間に生じる電圧(電流を流そうとするはたらきの強さ)を起電力という。
※負極と正極のイオン化傾向の差に相当する。
★負極→正極へ電子が移動する
負極での反応
負極の金属は相手に電子を放出してるので還元剤であり、負極の金属自身は電子を失っているので酸化反応を起こしている。
A → An ++ ne –
正極での反応
正極の金属自体は、渡された電子を処理できないので、水溶液中の電子がくっついて電子が処理される(電子をもらっているので還元反応)
実用電池(一次電池・二次電池・燃料電池)
★一次電池
充電できない電池
例 マンガン乾電池:正極に酸化マンガン (IV)MnO2,負極に亜鉛 Zn,電解質に塩化亜鉛 ZnCl2 を含む 水溶液を用いた一次電池。
★二次電池
充電によって繰り返し使用できる電池。蓄電池ともいう。
例1 鉛蓄電池
負極に鉛 Pb,正極に酸化鉛 (IV)PbO2,電解液に希硫酸を使用した電池。
負極の Pb の酸化数は単体なので0
正極の PbO2 の酸化数は酸素が2こなので+4
電子はバランスをとるから、正極に e -が2コ移動し,負極・正極ともに Pb2 +へと変化。
変化したPb2 +の性質として希硫酸中の硫酸イオン SO42 -と沈殿をつくるPbSO4 ↓これが両極に貼りつく。
充電するときには,逆の反応をさせたいので鉛蓄電池の負極へ電子を流したい。よって鉛蓄電池の負極に外部電源の負極をつなぐ。(逆に鉛蓄電池の正極を外部電源の正極につなぐ。)
例2 ニッケル−水素電池
負極に水素を吸収したり放出したりできる合金(水素吸蔵合金),正極にオキシ水酸化ニッケル (III)NiO(OH),電解質に水酸化カリウム KOH を用いた二次電池。
例3 リチウムイオン電池
★燃料電池
燃料が燃えるときに放出されるエネルギーを電気エネルギーに変えて取り出す装置。
※燃えるときに、二酸化炭素を出さず、地球に優しいのは水素のみ。
2 H2 + O2 → エネルギー+2 H2O
-120x120.jpg)
.jpg)
.jpg)
.jpg)
.jpg)