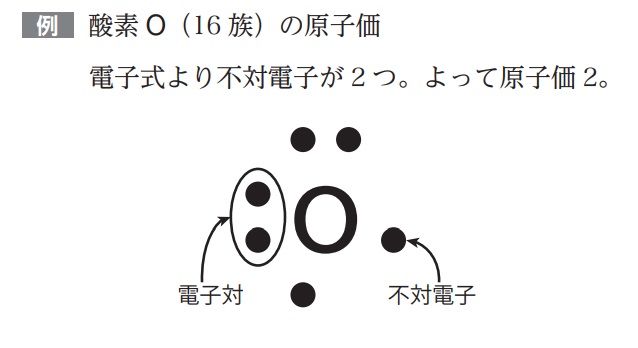
【復習】★原子価(不対電子)の数を求める方法
最外殻電子(価電子)をまず求める
最外殻電子について、上下左右2個ずつ(オクテット)のマスの中で、1マスだけの電子をイメージして答えればよい。
詳しく復習したい方はコチラ→化学基礎①《物質の構成》
化学結合結晶・電気陰性度
原子同士は、不対電子をお互いに出し合って、電子を共有することで結合する。
その共有した電子対がどちらのものになるかでイオン結合、金属結合、共有結合に分かれる。
他方で、片方が一方的に電子を提供することで結合するものを配位結合という。
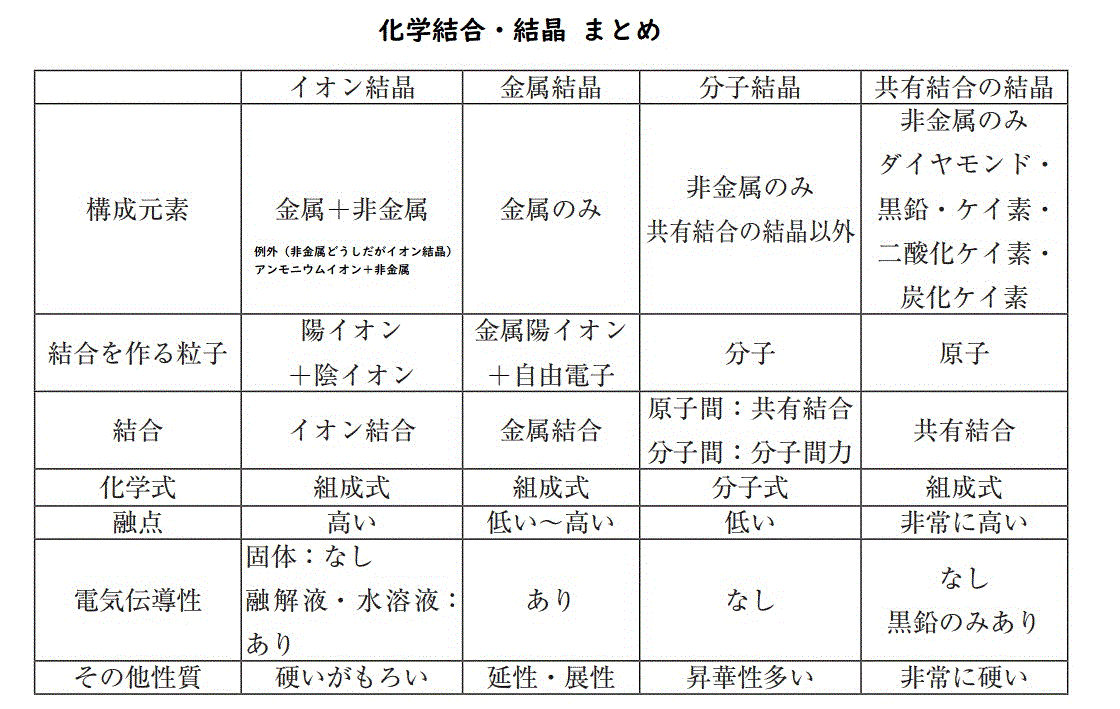
イオン結合結晶(金属と非金属がクーロン力で結合)
イオン結合とは、基本的に、金属と非金属がお互いに電子を出し合って、電子を共有することで結合することをさす。
*【例外:塩化アンモニウム NH4Cl】非金属元素どうしでもイオン結合になる。NH4+ Cl–
イオン結合の性質
非金属の方が電気陰性度★が大きいので共有電子対をひきつける
→ 非金属は-に帯電、金属は+に帯電
- 帯電するということは、他の同じように帯電しているものと結合し結晶をつくる。
- 帯電しているので、電気を通すが液体に溶かした場合のみ。《液体に溶けると電気を通すが、固体では電気を通さない》
- クーロン力(静電気力)で結晶がつながっているので、少しでも結晶がズレると+-が逆になり反発で壊れやすい《硬いがもろい》
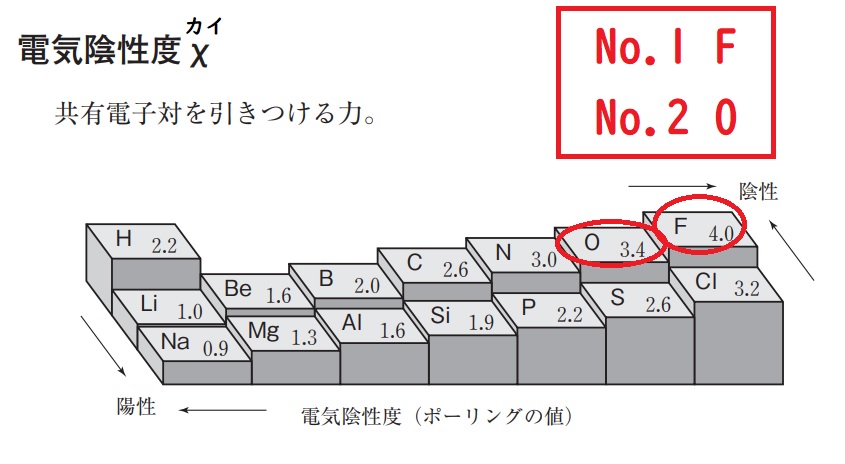
★電気陰性度とは、共有電子対を引きつける力。
電気陰性度の値=イオン化エネルギー+電子親和力として表せる。
イメージ
電気陰性度(電子をもらいたい)=イオン化エネルギー(大きいほど、電子をすてにくい)+電子親和力(大きいほど電子をもらいやすい)
つまり、電気陰性度≒イオン化エネルギーとして考えてよい。周期表の右上ほど、電気陰性度が大きい。
金属結合結晶
金属結合の性質
電気陰性度が小さい原子どうしなので、電子は誰にもひきつけることがなく、自由電子として動き回る。
- 電子が自由に動くので、電気や熱を通しやすい《電気伝導性、熱伝導性》
- 衝撃が与えられても、イオン結合とは異なり、電子がすぐに動き回って補完するので、+-がズレて++(–)となって反発するということがなく壊れにくい。《延性・展性がある》
- 金属光沢がある
非金属どうし(共有結合)
共有結合とは、原子どうしが不対電子を共有し合うことで結合すること。
★分子の表し方(分子式、電子式、構造式)
★配位結合
★分子間力
①ファンデルワールス力、②水素結合によって生じる力。
ファンデルワールス力とは、
全ての分子の中で、常に”電子の移動”が起こっているため、分子に”瞬間的な電荷の偏り”が生じ、瞬間的に生じたマイナスとプラスが引き合うことで起こる引力のこと。
水素結合によって生じる力とは、
水素H原子と結合しているフッ素F・酸素O・窒素N原子は、水素H原子よりも電気陰性度が大きいため、水素H原子と共有している電子対を引っ張り、マイナスに帯電する。これによって生じたマイナスとプラスが引き合う引力をさす。
例えば、水を例にすると、水素H原子と結合している酸素O原子はマイナスに帯電し、水素H原子はプラスに帯電する。この電荷の偏りによって、他の分子に影響を与える。
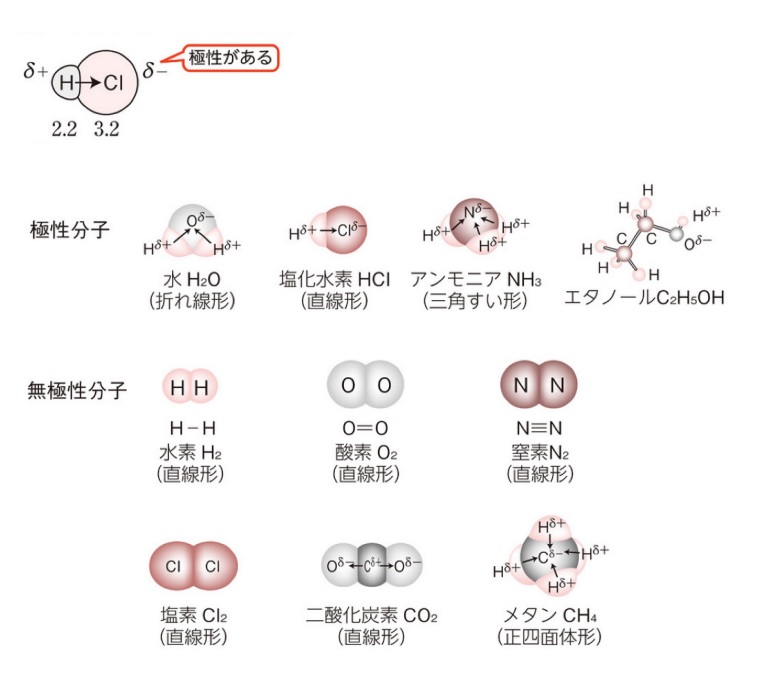
★分子の極性
極性とは、電気陰性度の違いや形で、分子間で+-が生じることをさす。
*δ(デルタ)は、少し帯電という意味。
無極性分子→単体、例外として化合物でも形的に無極性になるもの(二酸化炭素、メタン)
極性分子→化合物(違う種類の原子からなる)
固体:共有結合の結晶、分子結晶、高分子化合物
★共有結合の結晶(5つだけ暗記)
ダイヤモンド C
黒鉛 C
ケイ素 Si
二酸化ケイ素 SiO2
炭化ケイ素 SiC
★分子結晶《5つの共有結合の結晶に該当しないもの》
共有結合と比べると結合力(ファンデルワールス力)が弱いので、分子結合結晶(例:ヨウ素)は昇華性が多い。
★高分子化合物
高分子化合物とは、同じような形をした原子のまとまりが、繰りかえし結合し、分子量が約1万以上結合した物質のこと。
もともとの同じような形をした原子のまとまりを、単量体(モノマー)という。
単量体が繰り返し結合してできた物質を、重合体(ポリマー)という。
繰りかえし結合するやり方によって、付加重合と縮合重合の2種類ある。
★付加重合は、もともと二重結合だったものが、ひらいて単結合となり、別の分子と結合する反応のこと。
例 エチレン(モノマー)⇒ポリエチレン(ポリマー)
★縮合重合は、もともとの分子の中で簡単なものがとれて、大きなものが別の分子の大きなものと結合していく反応のこと。
組成式、分子式、示性式の違い
高分子化合物のような、構成する原子の数が大量にあったり、構成する原子の数が決まっていない場合に組成式が使われる。
例
金属結晶、イオン結晶、共有結合結晶⇒組成式が使われる
分子結晶⇒分子式が使われる
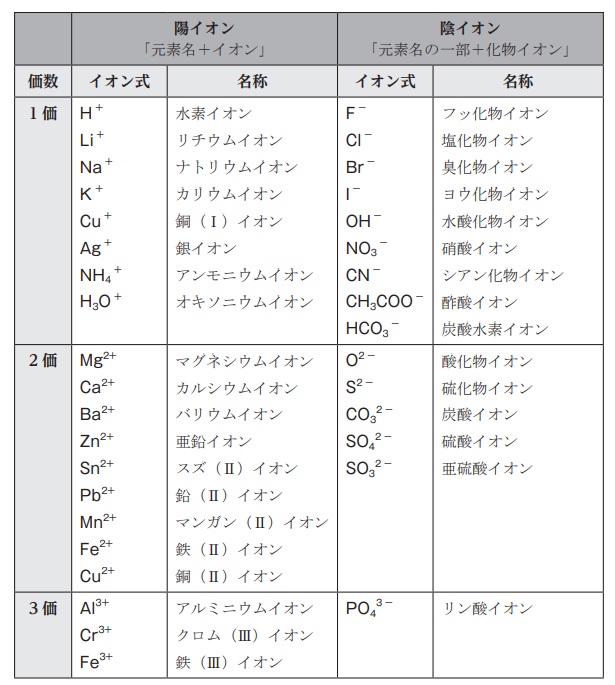
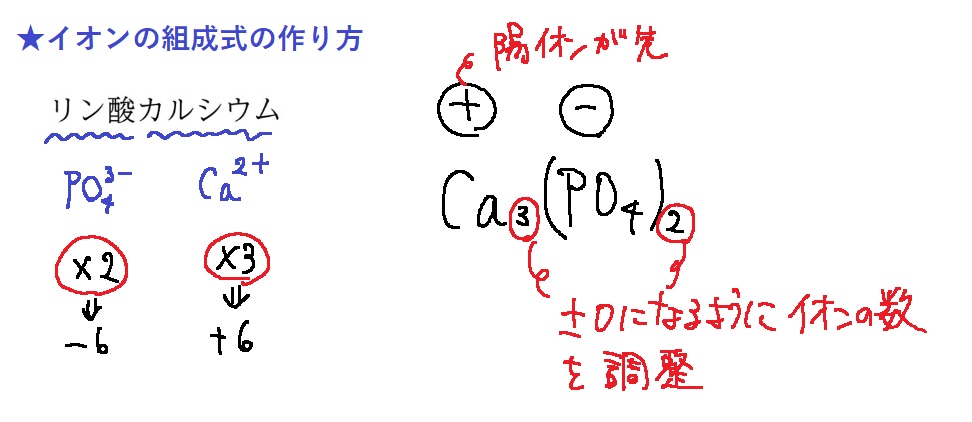
イオンの組成式の作り方
まず、イオン式は暗記する。
陽イオン、陰イオンの順に書き、あとは±0になるようにイオン数を調整すればOK
テストで90点以上が取れるコツ
1、学校のワーク(問題集)をテスト1週間前までに解き終わり基本を身につける。
2、定期テスト過去問を解く。
3、入試問題(正答率20%以下)を解く。
定期テスト過去問を解くだけでも、十分な得点を狙えます。
しかし、満点を狙いたい方へ。
学校の先生によっては、100点を防ぐために、入試問題まで出題される方がいらっしゃいます。
受験ガチ勢チートでは、受験のプロが完全無料で、入試問題を丁寧にわかりやすく解説しています。
是非、チャンネル登録をお願いいたします↓↓
-120x120.jpg)
.jpg)
.jpg)
.png)
.png)
.png)
非共有電子対を他の原子と共有してできる結合のこと.png)
.jpg)
.jpg)