【大学入試】化学~目次一覧~
第1編 物質の状態
粒子の結合と結晶の構造
物質の状態変化
気体 ⇒現在はここのページ
溶液
第2編 物質の変化
化学反応とエネルギー
電池と電気分解
化学反応の速さとしくみ
化学平衡
第3編 無機物質
非金属元素
金属元素Ⅰ 典型元素
金属元素Ⅱ 遷移元素
第4編 有機化合物
有機化合物の分類と分析
脂肪族炭化水素
アルコールと関連化合物
芳香族化合物
第5編 高分子化合物
天然高分子化合物
合成高分子化合物
計17章ほど
【大学入試】化学《気体》重要語句と典型問題まとめ・総チェック
計算問題における「気体」の考え方
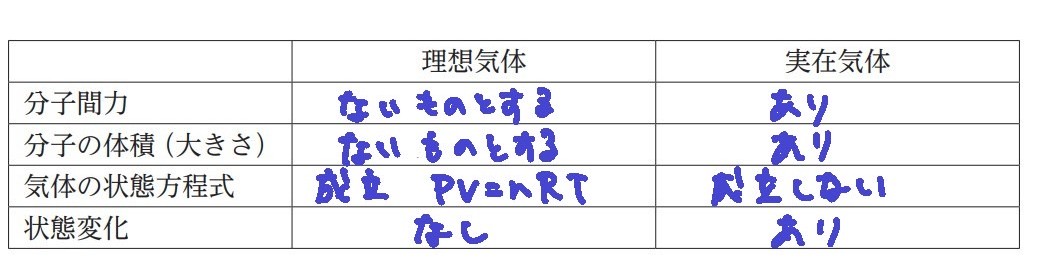
①分子間で引き合う、分子間力は無いものとして考える
分子間の引力よりも、熱運動による力の方が強すぎるため。
②分子自体の体積(大きさ)は無いものとして考える
分子自体の体積よりも、気体の体積(気体が入っている容器の体積)が大きすぎるため。
気体の圧力とは
★気体の圧力とは
気体分子が壁にぶつかる力(単位面積当たり)をさす。
★圧力の単位
①パスカル(Pa)…標準大気圧1.013 × 105Pa
②ミリメール水銀柱(mmHg)…標準大気圧760mmHg
※水銀で満たした液体の中に、容器を入れ、その中で立てると、標準大気圧と水銀柱760mmの高さになるということ。
③アトム(atm)…標準大気圧を 1atm とする。
気体の体積、気体の温度とは
★気体の体積 V
分子自体の体積ではなく、気体分子が自由に動き回れる空間の広さ(気体が入っている容器の体積)をさす。
★温度 T
絶対温度(K)= セルシウス温度(°C)+ 273
*化学では、いつもの「~度」ではなく、「~ ケルビン k 」を使うこと。
気体の法則
P:圧力
V:体積
T:絶対温度(セルシウス温度+273)
これら3つの関係が、
ボイルの法則:VとPは反比例
シャルルの法則:VとTは比例
となることを気体の法則という。
これらを式にしたものが、
$ \frac{PV}{T} = \frac{P’V’}{T’} $
気体の状態方程式とは
そもそも圧力は、気体分子が壁にぶつかる力のことをいうため、
→圧力は、分子の運動エネルギー、つまり温度(K)に比例する。
→圧力は、分子の数(mol)、つまり単位体積あたりの分子の数(mol/L)に比例する。
※なぜ分子の数を「単位体積あたり」で考える必要があるか?
大きい容器に2粒であっても、とても小さい容器に1粒であれば、単純に2:1ではないから
よって、
圧力P=温度T(K)✖️単位体積あたりの分子数n/V(mol/L)✖️気体定数R
→分母(V)を払って変形した式で覚えよう!
PV=n R T
圧力✖️体積=モル✖️気体定数✖️温度
*物質量(モル数)n:mole number
*気体定数R:8.3×10^3 Pa L/(K mol)
PV=n R T をさらに変形していく。
変形で使う単位は、
W(質量g)
M(分子量)*分子量:molecular weight
d(密度)*密度:density
まずは、n(物質量)=W(質量g)÷ M(分子量)より、
PV=W/M RT と変形できる。
次にd(密度)=質量w÷体積Vより、
PV=W/M ・RT
P=W/M ・RT /V
P=d/M ・RT
1/P=M /R /T /d
RTd/P =M
気体の分子量測定実験(デュマ法)
気体の分子量測定実験(デュマ法)とは
ピクノメーター(メスフラスコに「小さな穴の開いた蓋」をしたもの)を使って気体の密度を測定し,気体の分子量を求める実験のこと。
RTd/P =M より、密度dさえわかれば、
他の気体定数R、温度T、大気圧Pは一定なので、分子量Mがわかる。
実験内容(求めたい気体の体積と質量をはかりとり、密度を計算する。密度がわかれば分子量がわかる。)
①空気だけが入ったメスフラスコの質量をはかっておく。
②分子量を求めたい気体を液体にしたものを、メスフラスコの中にいれる。(液体の量は適当でよい)
③メスフラスコを恒温槽(温度を一定に調整できる槽)に入れて、液体を蒸発させてメスフラスコ内を満たす。…これで気体の体積がわかる。メスフラスコと同じ体積だから。
④メスフラスコを冷却して、求めたい気体を液体へ戻すと、空気がメスフラスコ内に戻ってくる。
⑤最初の空気だけが入ったメスフラスコの質量と、液体と空気が入ったメスフラスコの質量を比較すれば、液体(メスフラスコを満たしていた気体)の質量がわかる。
混合気体
平均分子量(見かけの分子量)とは
★平均分子量(見かけの分子量)*そのままモルの比を使って、平均の計算をするだけ。
ある体積の空間内で、気体が混合している場合に(例:空気は窒素や酸素の混合気体)
気体Aをa mol、気体Bを b mol …として、モルの割合(モル分率)を求めて、
混合気体の分子量の平均を出すことをさす。
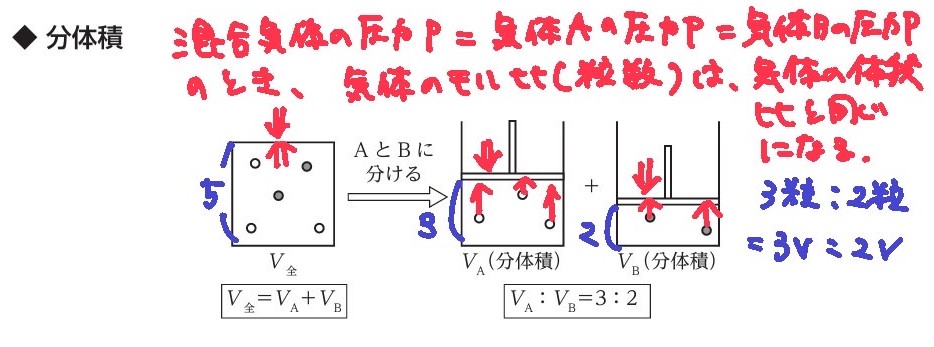
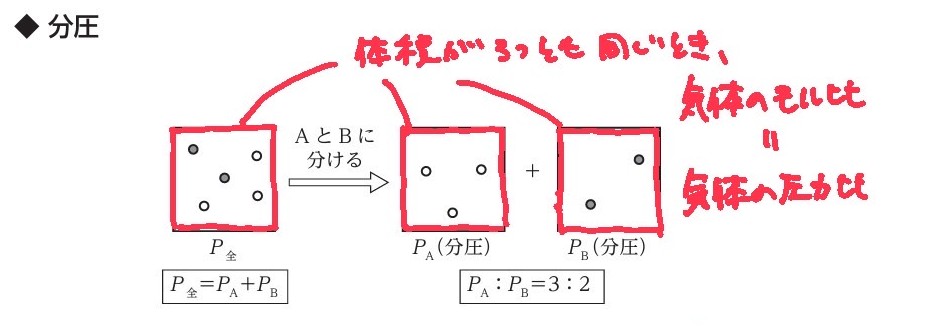
分体積とは
★分体積
混合気体の全体の体積を、それぞれの成分気体の体積に分けたものをさす。
*言い方を変えると、それぞれの成分気体の体積を足し算をすると、混合気体の全体の体積になる。
PV=n R T より、
圧力Pと温度Tが一定であれば(PとTとRは一定値となり)、
V=n「体積比=mol比」が成立することから、
分体積の比は、モル比と同じになる。
混合気体の全圧と分圧とは
★全圧
混合気体の示す圧力をさす。
★分圧
全圧を、それぞれの成分気体の圧力に分けたものをさす。
*言い方を変えると、それぞれの成分気体の圧力を足し算をすると、混合気体の全体の圧力になる。
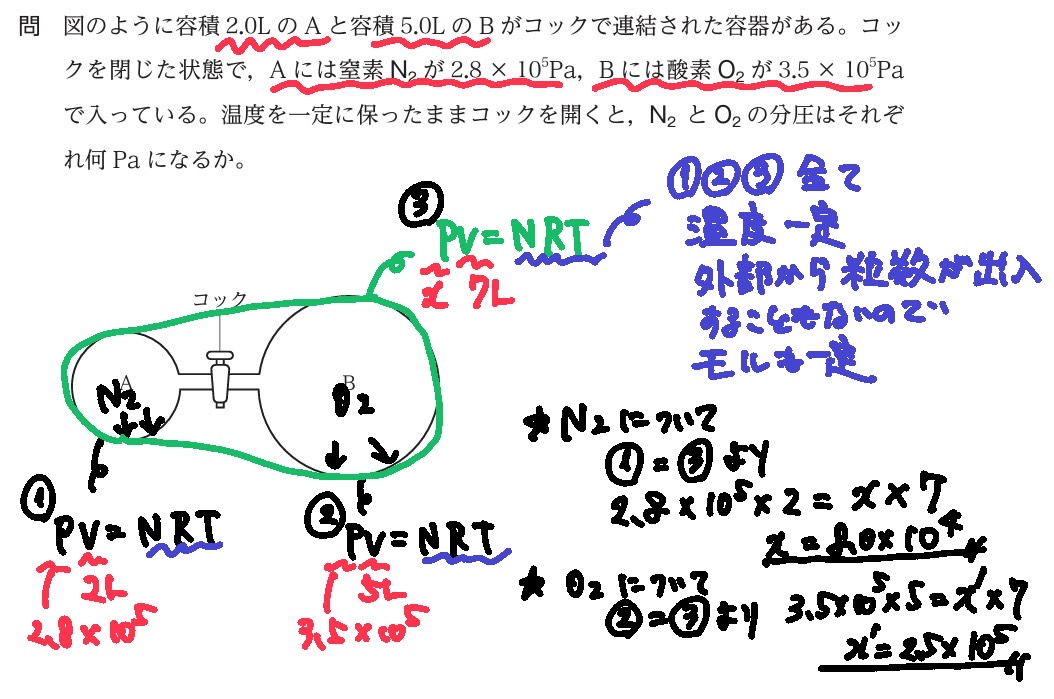
PV=n R T より、
体積Vと温度Tが一定であれば、
P=n「分圧比=mol比」が成立する。
このとき、圧力×体積(P×V)が一定値(NRT)になるので、
コックを開ける前のそれぞれの気体の圧力×体積(PV)と、コックを開けてそれぞれ体積を大きくしたときの圧力を、等式によって求めることができる。
飽和蒸気圧(Pmax)とは
《ポイント》
水、エタノール、エーテルなど、
これらが気体であるとき「蒸気」といい、圧力が高すぎると100度以上だとしても、液体になってしまうことから問題となる。
★飽和蒸気圧とは
蒸気の圧力の限界値。
また,飽和蒸気圧と温度の関係をグラフにしたものを蒸気圧曲線という。
この曲線状にあるときは、気体と液体が共存している
蒸気を含む気体の計算問題
手順
→まずは、全て気体と仮定して、普通の気体の問題と同じように圧力Pを求める。
→求めた圧力Pと、飽和水蒸気圧Pmaxを比較して、答えを修正する(気体の圧力の限界値を超えることができない)。
①P>Pmaxの場合、気体の圧力の限界値を超えているため、一部、気体が液体に変わっている状態といえる。気体の圧力は、限界値のPmaxの値に修正する必要がある。
②P≦Pmaxの場合、気体の圧力の限界値は超えていないため、気体のみといえ、計算結果はそのまま気圧Pの値を使ってよい。
液体の水が存在しているときの気体の計算問題(水上置換)
★水上置換というヒントでわかること
・大気圧と、容器内(メスシリンダーなど)の圧力が同じ
・水上置換によって回収した気体Aと、水(水蒸気:気体B)が飽和水蒸気圧で混ざっていること
・水上置換によって回収した気体Aの体積は、気体Aと気体Bの混合気体全体の体積と同じであること。分圧が成立するから、体積は同じ。
理想気体とは、実在気体とは
★体積の違いについて
分子自体の体積(高圧の状況下では、単位あたりの分子自体の大きさが無視できない)
ほんとうであれば(実在気体であれば)、分子自体の体積があるため、その分体積が大きくなる。
しかし、低圧であれば、スカスカな状態であり気体全体の体積が大きいから1粒の大きさは無視できる。よって実在気体は理想気体の状態に近づく。
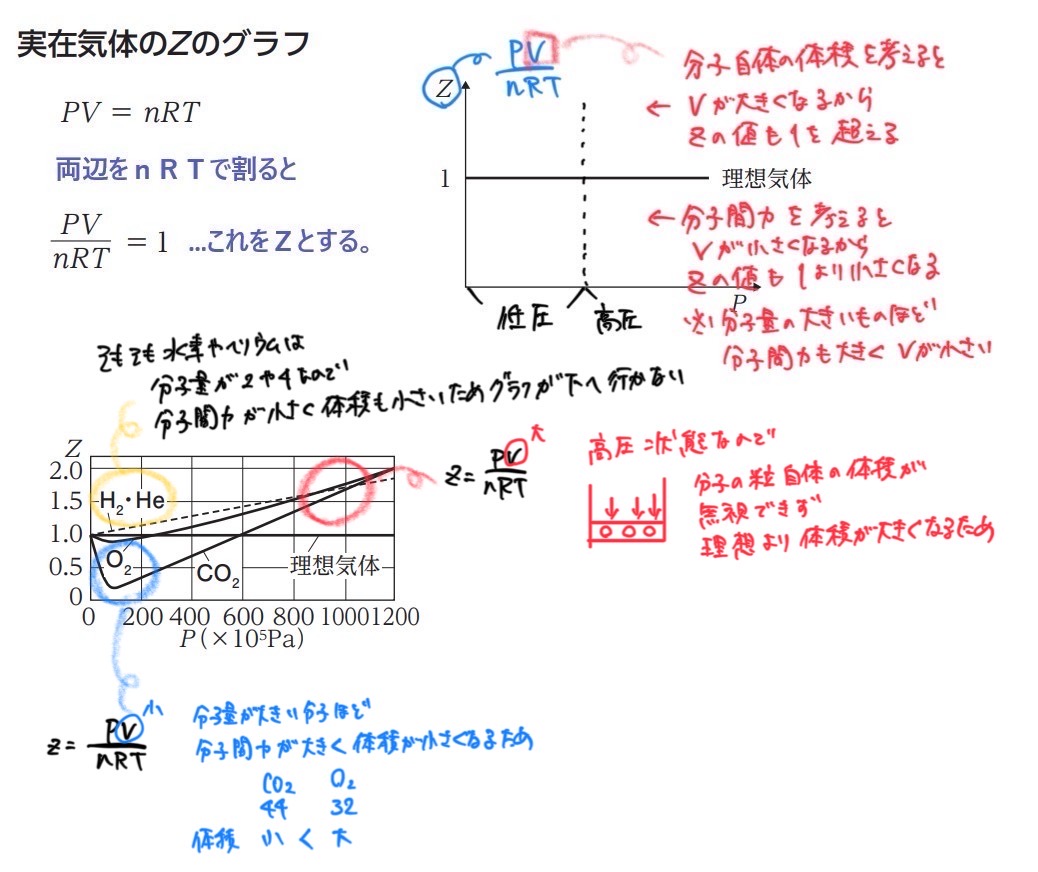
分子間力(分子量が大きい分子ほど、分子間力も大きい)
ほんとうであれば(実在気体であれば)、分子間力が働いて引きつけ合うため、体積が小さくなる。
しかし、高温にすれば、熱運動エネルギーが大きいから分子間力を無視できる。よって、実在気体は理想気体の状態に近づく。
《Zグラフ》実在気体と理想気体を、見た目で判断するためのグラフ
注意:Zグラフには、温度が考慮されていない(温度は一定)ので、高温にすれば分子間力が無視できるということは考えていない。
-120x120.jpg)
.jpg)

計算問題の解き方.jpg)
.jpg)
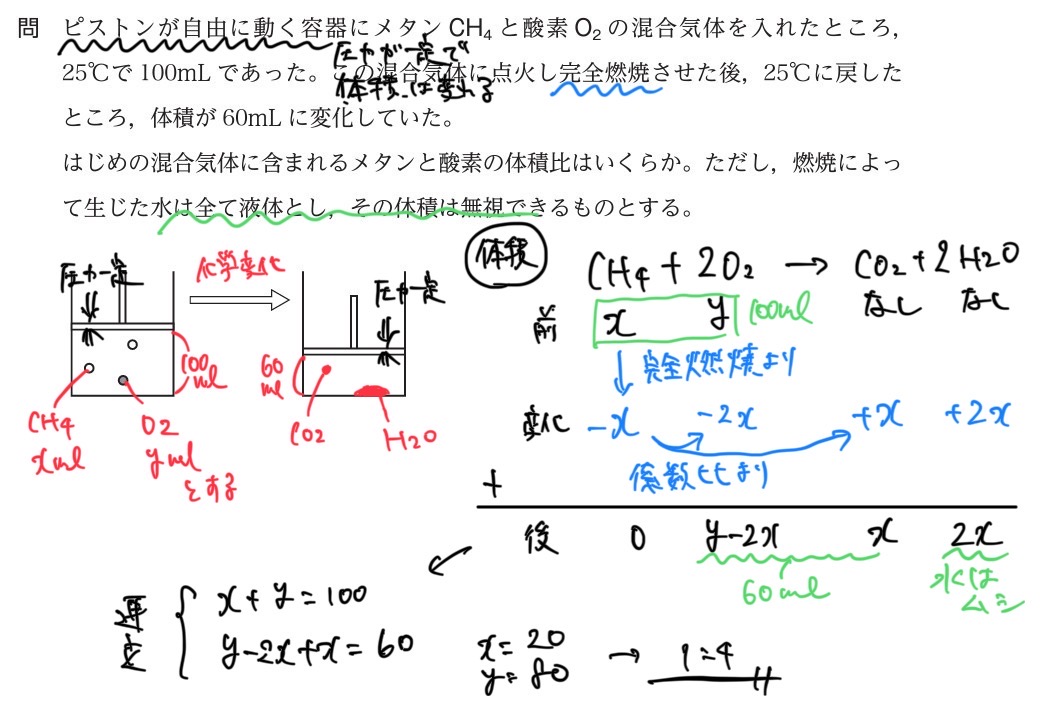

.jpg)
.jpg)

.jpg)