高校化学~目次~
第1編 物質の状態
粒子の結合と結晶の構造
物質の状態変化
気体
溶液
第2編 物質の変化
化学反応とエネルギー ⇒現在はここのページ
電池と電気分解
化学反応の速さとしくみ
化学平衡
第3編 無機物質
非金属元素
金属元素Ⅰ 典型元素
金属元素Ⅱ 遷移元素
第4編 有機化合物
有機化合物の分類と分析
脂肪族炭化水素
アルコールと関連化合物
芳香族化合物
第5編 高分子化合物
天然高分子化合物
合成高分子化合物
計17章ほど
高校化学《化学反応と熱・光エネルギー》重要語句と典型問題まとめ・総チェック
化学反応とエンタルピー
★エンタルピーとは
物質がもつエネルギーのこと。熱含量ともいう。
H という記号で表す。
★エンタルピー変化とは
化学反応が起こる前に物質が持っていたエンタルピーと、化学反応後に持つエンタルピーの差をさす。
ΔH という記号で表す。
Δ デルタの意味:差分や変化分、微分値等を表すギリシャ文字。熱力学的パラメータの差を表現するときに使われる。
例 発熱反応では、エンタルピー変化はマイナスとなる。
理由:反応前の物質のエンタルピーの一部が、熱エネルギーに変換され、反応後の物質はその分だけエンタルピーが失われるため。
例 吸熱反応では、エンタルピー変化はプラスとなる。
エンタルピー変化を付した反応式の書き方・ルール3つ
通常の化学反応式には、エネルギーの表記がない。
そこで、エネルギーの変化を化学反応式に盛り込んだものが書けると、式を見るだけで色々わかるので便利である。
ルール①
ここで、エネルギーは同じ物質でも、液体や気体などの状態によってエンタルピーが違うので、状態を書く必要がある。
*ただし、常温常圧で気体の(気)は省略されることが多い。
ルール②
主語となる物質(~の)の係数を1にする。
例 水素の燃焼エンタルピーが-286KJ/mol
⇒「水素の」となっているため、水素が主語であり、化学反応式での係数を1とする。
ルール③
主語を1にすることで、化学反応式の最後につけたす「ΔH=数字」に「/mol」をつける必要がなくなる。
反応エンタルピーの種類・定義
代表的な反応エンタルピーには固有の名称がついている。
定義をしっかりと暗記しよう。
主語である注目する物質を1molあたり(係数1)で表すため,エンタルピーの単位が(kJ/mol)になる。
⇒化学反応式の後ろに書かれているエンタルピー変化は必ず1㏖あたりのKJとなっている。
燃焼エンタルピー
物質1molが完全燃焼化合物になるときのエンタルピー変化。
燃焼反応は発熱なので,ΔH は必ず負の値となる。
例 一酸化炭素と酸素から二酸化炭素ができる反応:−283kJ/mol(CO の燃焼エンタルピー)
生成エンタルピー
物質1molが構成元素の単体から化合物が生成するときのエンタルピー変化。
発熱も吸熱もある。
例 窒素と酸素から一酸化窒素が生成する反応:90.3kJ/mol(NO の生成エンタルピー)
*完全燃焼化合物の生成エンタルピーについては、燃焼エンタルピーと一致する。例 二酸化炭素の生成エンタルピー=黒鉛の燃焼エンタルピー=-394KJ/mol
溶解エンタルピー
物質1molが多量の溶媒に溶解するときのエンタルピー変化。
溶媒が水の場合が多く、「多量の水」を「aq」と表す。
発熱も吸熱もある。
例 固体の水酸化ナトリウムに水を加えて、水酸化ナトリウム水溶液にする反応:− 44.5kJ/mol(NaOHの水に対する溶解エンタルピー)
中和エンタルピー
酸と塩基が反応し,水1molが生成するときのエンタルピー変化。
中和反応は発熱なので,ΔH は必ず負の値となる。
*強酸と強塩基の場合、完全に電離しているため、塩酸と使おうと硝酸を使おうと、
「H+aq + OH − aq → H2O(液)ΔH =−56.5kJ」という式になる。どちらの場合でも変わらない。
状態変化のエンタルピー(融解、蒸発)
1.013 ×105Pa 下での状態変化によるエンタルピー変化。
固体<液体<気体の順に、熱量をもらって(吸熱して)変化していく。
つまり、固体<液体<気体の順に、エンタルピーが高くなる。
融解=吸熱反応(熱量を吸収して固体から液体になる)
蒸発=吸熱反応(熱量を吸収して液体から気体になる)
結合エネルギー(昇華エネルギーも同様)
気体の原子間結合 1mol を切断し,原子にするために必要なエネルギー
「必要な」エネルギーであるため,吸熱反応すなわちエンタルピー変化は必ず+となる。
反応熱の求め方
反応熱、つまり、どのくらいの「熱量が放出されるか」という問題は、発熱反応であれば+、吸熱反応であればーとなる。
しかし、化学反応式の最後に書いてあるエンタルピー変化は、「変化」であるがゆえに、変化後と変化前の引き算となってしまっているため、発熱反応であればー、吸熱反応は+となってしまっている。
そこで、反応熱を求めるときには、エンタルピー変化の符合を逆にする必要がある。
また、反応式の最後にあるエンタルピー変化が1モルあたりの熱量KJを表現しているので、それが何モルあるかを掛け算すれば熱量KJが求められる。
公式
熱量(KJ)=注目する物質の反応エンタルピー変化(*)×注目物質の物質量
(*)は逆符号にする。
例 メタンCH4(分子量16)の燃焼エンタルピーは−891kJ/molである。
メタン32gが燃焼すると何kJの熱量が放出されるか。
解法 メタン16gなので、32g ÷ 分子量16 = 2 molとわかる。
よって、公式にあてはめて、+891×2=1782kJ
*メタンの燃焼エンタルピーが−891kJ/molと、マイナスなので、発熱反応をする反応だとわかる。
公式にあてはめるときに、符号を逆にすることに注意。
検算として、出てきた答えは発熱反応なので、放出される熱量はプラス(1782kJ)になっているのでOK。
ΔH エンタルピー変化(反応エンタルピー)の求め方
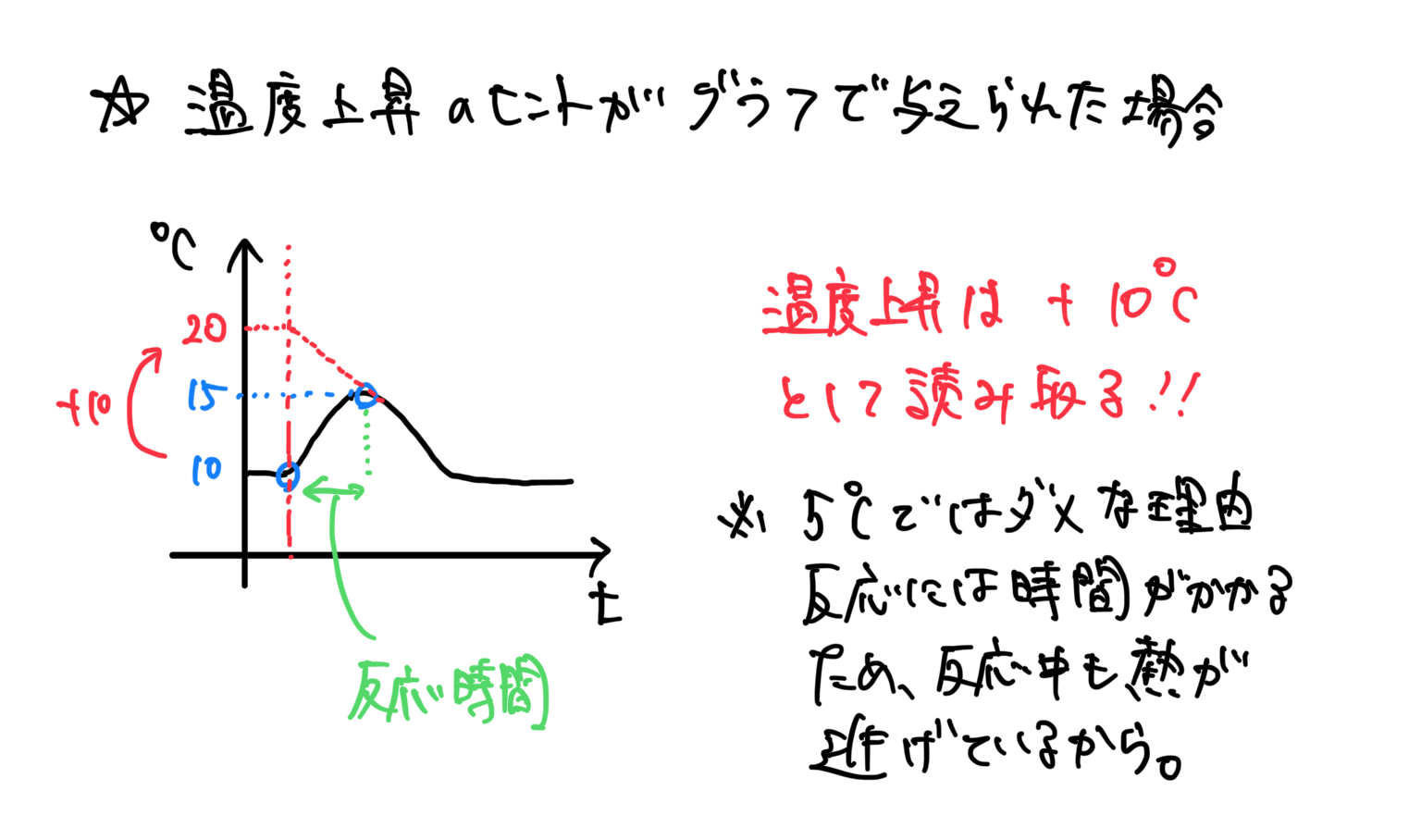
そもそもエンタルピー変化 ΔH の単位は、熱量KJであるから、もし問題文のヒントで、「温度上昇℃と比熱」があたえられたら、℃を熱量KJに変換することで求めることができる。
つまり、熱量の2つの式で使って、方程式をつくることでΔH(KJ)を求めることができる。
熱量(J)
=注目する物質の反応エンタルピー変化(*)×注目物質の物質量×1000 (*)は逆符号にする。
=比熱J/g・℃ ×溶液の質量g ×温度上昇度℃
注意点
*比熱の単位がJで、エンタルピー変化の単位がkJなので、エンタルピーを×1000をして単位をJにそろえる必要がある。
*温度上昇度℃は、グラフの延長線上を読み取る必要がある。理由:反応には時間がかかるため、反応中にも熱が発生し逃げ続けるので、正確な上昇度を読み取れないため。
例 塩化カリウムKCl 0.050molを水100mLに溶解させたところ,水溶液の温度が2.0℃下がった。この結果を使って塩化カリウムの溶解エンタルピーを求めなさい。ただし,混合してできた塩化カリウム水溶液の質量は104g,比熱は4.2(J/g・℃)とする。
解法
公式に代入するだけ
熱量(J)
=注目する物質のエンタルピー×注目物質の物質量×1000
=比熱J/g・℃ ×溶液の質量g ×温度上昇度℃
水溶液の温度が2.0℃下がった。
→この表現から、そのパワー(熱量)は、「比熱J/g・℃ ×溶液の質量g ×温度上昇度℃」で求められる。
4.2 × 104 × -2
また、求めるエンタルピーをΔH(熱量)とすると、モルの分だけ熱量は大きくなるから
-ΔH × 0.050mol ×1000
*公式にあてはめるときは、ΔHの符号を逆にすること。
これらを等式で結ぶと、
4.2 × 104 × -2 = -ΔH × 0.050mol ×1000
ΔH = 17.4
*検算で、-2℃の吸熱反応する物質なので、答えのΔHはプラスであることを確認。
ヘスの法則(総熱量保存の法則)を利用した反応エンタルピー(A→B)の求め方
求めたいエンタルピー変化 ΔH (A→B)があるとする。
しかし、温度℃が測定できない場合など測定が困難な場合、別の経路(A→C、C→B)によって求めることができる。
*イメージはベクトルと同じ。
★ヘスの法則(総熱量保存の法則)
物質が変化するときの反応エンタルピーの総和は,変化前後の物質の種類と状態のみで決まり,変化の経路や方法には関係しない。
ヘスの法則を利用して、反応エンタルピー(A→B)を求める解法には、
①化学反応式のやりくりするやり方
②エンタルピー図を使ったやり方
の2種類があるが、エンタルピー図を使ったやり方が簡単である。
そこで、経路を表現した「エンタルピー変化を表した図」が必要となる。
エンタルピー図の書き方
燃焼エンタルピー
⇒完全燃焼化合物のレベル(一番下)に書き込む
生成エンタルピー
⇒定義より、単体から化合物のレベルに書き込む
結合エネルギー、昇華エネルギー
⇒定義より、原子レベルへ分解するように書き込む
手順
1 仲間はずれのヒント(反応エンタルピーの種類が違う)の化学反応式を書き込む
2 残りのヒントを書き入れる(化学反応式を書く必要はない)
*同じレベルの場合、同じレベルを増やして、化学反応式で左辺が上、右辺を下とする。
例 C(黒鉛)→C(ダイヤモンド)生成
原子
単体 黒鉛
単体 ダイヤモンド
化合物
ヘスの法則(総熱量保存の法則)かつエンタルピー図を使って、反応エンタルピーを求める方法
化学反応が自発的に進む向き・化学反応と光
①発熱反応(エンタルピーが減少する方向)は自発的に進む
②バラバラになる方向(エントロピーが増加する方向)は自発的に進む
例 強酸の電離 HCl→H++Cl−
発熱反応であり①、バラバラに電離するため②、進みやすい。
例 弱酸の電離 CH3 COOH ⇔ CH3 COO− + H+
バラバラに電離するものの②、吸熱反応である①、そのため可逆反応としてどっちにも進みやすい。
光とエネルギー
今まで「熱」について、発熱や吸熱などを見てきたが、
同様にして、「光」について、発光などを見ていく。
化学発光とは
化学発光とは
反応により光が放出されること
例 ルミノール:血痕の検出に用いられる。塩基性溶液中で過酸化水素やオゾンなどにより酸化されると明るく青い光を発する。
例 シュウ酸ジフェニル:過酸化水素で酸化されると,放出されるエネルギーを蛍光物質に与える。
光化学反応とは
光化学反応とは
光を当てると起こる・促進される化学反応のこと
例 光合成:植物が光を吸収し,二酸化炭素と水から糖類を合成する反応
例 光触媒:光が当たると触媒の働きを示す 酸化チタン(Ⅳ)TiO2
例 水素と塩素の反応(H2 + Cl2 → 2HCl):水素と塩素の混合気体に強い光を当てると,爆発的に反応が進み塩化水素が生成
例 有機化合物の反応:有機化合物の反応には,光が当たると起こるものが多くある
このページが終わった方へ
次の高校化学の単元はコチラ
⇒電池と電気分解《重要語句と典型問題まとめ・総チェック》
-120x120.jpg)
.jpg)


.jpg)
.jpg)
かつエンタルピー図を使って、反応エンタルピーを求める方法①.jpg)
かつエンタルピー図を使って、反応エンタルピーを求める方法①解答.png)
を利用した反応エンタルピーの求め方.jpg)