【大学入試】化学~目次一覧~
第1編 物質の状態
粒子の結合と結晶の構造 ⇒現在はここのページ
物質の状態変化
気体
溶液
第2編 物質の変化
化学反応とエネルギー
電池と電気分解
化学反応の速さとしくみ
化学平衡
第3編 無機物質
非金属元素
金属元素Ⅰ 典型元素
金属元素Ⅱ 遷移元素
第4編 有機化合物
有機化合物の分類と分析
脂肪族炭化水素
アルコールと関連化合物
芳香族化合物
第5編 高分子化合物
天然高分子化合物
合成高分子化合物
計17章ほど
【大学入試】化学《粒子の結合と結晶の構造》重要語句と典型問題まとめ・総チェック
結晶とは
★結晶とは
粒子が規則正しく配列した固体のこと。
★結晶の4種類
金属結晶
イオン結晶(金属原子と非金属原子の結合)
共有結合の結晶(ダイヤモンド、、黒鉛、ケイ素、二酸化ケイ素、炭化ケイ素)
分子結晶(非金属元素のみからできていて共有結合の結晶の5つ)以外)
→規則正しいので、繰り返される単位を考えることができる。
★単位結晶(単位格子)とは
結晶構造の最小の繰り返しの単位をさす。
★単位結晶の条件
・六面体(さいころ、四角柱)
・全ての頂点に同じ粒子が配列している
金属結晶とは
金属結晶とは
金属結合(金属の陽イオンと自由電子による結合)による結晶をさす。
配位数(最近接粒子数)とは
1個の粒子に接している粒子の数のこと。
配位数の最大値(最密構造)とは
配位数の最大値は 12 であり、その結晶構造を最密構造という。
最密構造イメージ①(正六角柱の形)
粒の上…3つ
粒の横…ポンデリングみたいに6つ
粒の下…3つ
計12
最密構造イメージ②(面心立方格子の形、ページ下部参照)
粒の上…4つ
粒の横…ポンデリングみたいに4つ
粒の下…4つ
計12
金属結晶の配位数について
配位数 12(最大値)と8のどちらかの構造となる。
体心立方格子、面心立方格子、六方最密構造
粒子が規則正しく配列した固体(結晶)について
規則正しいがゆえに、最小の繰り返しの単位(単位結晶)を考えることができ、
特に金属は、1個の粒子に接している粒子の数(配位数)が12か、8となる。
体心立方格子(配位数が8の場合)
面心立方格子(配位数が12の場合)
六方最密構造(配位数が12の場合)
イオン結晶(金属原子と非金属原子の結合)
イオン結晶とは
イオン結合(陽イオンと陰イオンの間に働く静電気力(クーロン力)による結合)による結晶
イオン結晶の形
配位数8、6などの結晶構造をつくる。
基本的に、配位数(1個の粒子に接している粒子の数)について、陽イオンと陰イオンはくっついて安定するため,配位数は大きくなる。
しかし,陽イオンと陰イオンの大きさが異なるため,ポンデリングみたいなキレイな形をとることができず最大配位数の 12 をとることはできない。
イオン結晶(塩化セシウムCsCl型)
体心立方格子と似ている(配位数は同じ8)が、異なる点は以下
・粒の大きさが違う
金属が同じ大きさの粒であるのに対して、イオン結晶は立方体の中心に陽イオン(Cs)、頂点に陰イオン(Cl)となっていて粒の大きさが違う
・粒の数が違う
金属が同じ粒として考えるので2粒であるのに対して、イオン結晶は陽イオン1粒と陰イオンが1粒で合わせて、塩化セシウムという化合物1粒分となる。
→密度計算で違いが出る
イオン結晶(塩化ナトリウムNaCl型)
金属の面心立方格子(配位数12)との違い
・塩化ナトリウムNaCl型は、配位数が6になる
図だと見えないが、立方体の中心に小さなNa+がいる。このNa+はCl-と6個触れているので、配位数は6となる。
*Na+は他のNa+とは触れていない。
*切り口を変えて、Cl-を同じように立方体の中心にして考えると、Na+と同様なことが言える(Cl-は6個のNa+と触れている)ので、配位数は6となる。
・粒の数が違う
スキマに陽イオンが入っている
→つまり、面心立方格子は4粒あったから、陰イオンは4粒。さらに陽イオンも同じ4粒スキマに入っていることになる。
合わせて、4粒の化合物となる。
共有結合の結晶
共有結合(非金属原子間で電子対を共有する結合)のみでできている結晶をさす。
ダイヤモンド
ケイ素
二酸化ケイ素
炭化ケイ素
黒鉛
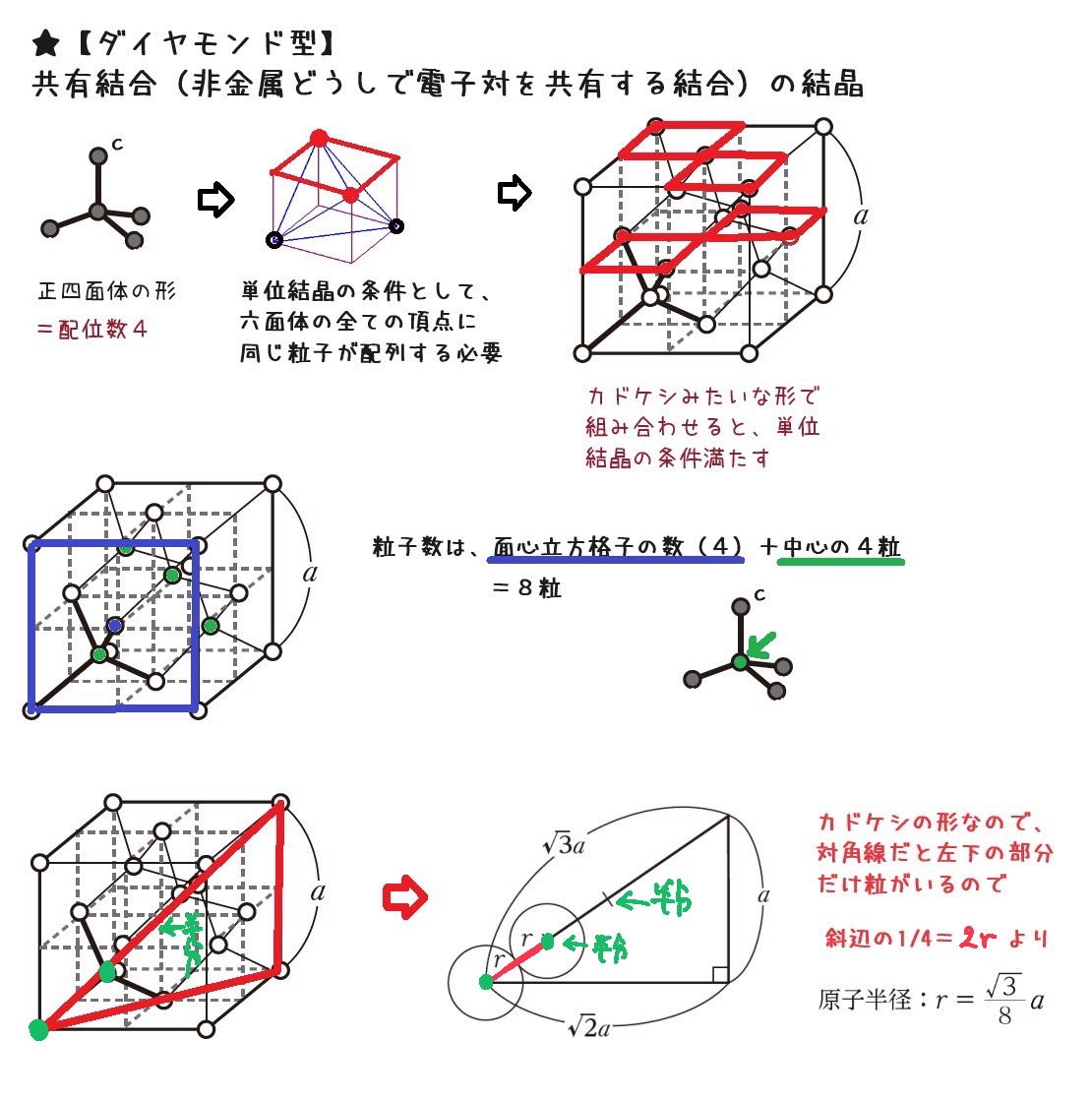
共有結合の結晶(ダイヤモンド型)
Cの原子番号は6
最外殻電子(価電子)は4
4本ということは、電子配置が正四面体の構造になるが、
単位結晶(単位格子)を考える条件として、六面体の全ての頂点に同じ粒子が配列している必要があるので、
正四面体のまま(サイコロ(六面体)1つ分)では、全ての頂点に粒子がいるという条件を欠く。
そこで、カドケシみたいな形のサイコロ4つ分を考える(空白入れるとサイコロ8つ分を組み合わせた形)
この形は、単位格子全体の面を見るとわかると思うが、面心立方格子に似ている。
違う点は、立方体内部の粒子4分が追加される(面心立方格子は頂点8つ×1/8粒と、面6×1/2粒で計4粒で、いずれも頂点と面に接するもので、立方体内部には粒子がなかった)。
つまり、粒数は4+4=8粒。
半径は、単位格子全体をaとすると、その対角線を使った直角三角形を考えると良い。
共有結合の結晶(黒鉛型)
*黒鉛以外(ダイヤモンド、ケイ素、二酸化ケイ素、炭化ケイ素)はダイヤモンド型になる。
Cの最外殻電子(価電子)4本のうち、3本を共有結合に使い(配位数は3)
→1つのCから3本出るので、蜂の巣のような正六角形ができる
→正六角形がつながった層が、上下で、パイの実みたいにつながっている(つながり方は、ファンデルワールス力なので弱いつながり)
→単位格子として規則的に考えるときは、層の上下で正六角柱として考える
残りの1本は、自由電子のように動き回る
→自由電子ということは黒鉛は電気を通す
分子結晶(非金属元素のみからできていて共有結合の結晶の5つ)以外)
分子結晶とは
分子間力(共有結合やイオン結合のような原子間の 結合に比べると非常に弱い。)によって分子が多数集まってできる結晶のこと。
非金属元素のみからできていて,共有結合の結晶の5つ(ダイヤモンド・ケイ素・二酸化ケイ素・ 炭化ケイ素・黒鉛)以外はすべて分子結晶となると考えてよい。
分子間力の種類
①ファンデルワールス力
②水素結合
①ファンデルワールスとは
どんな分子の間にも働く弱い引力をファンデルワールス力という。
分子量が大きいほど強く,融点や沸点が高くなる
分子量が同じときは,分子の形が球状に近いほど弱い
極性分子は極性による引力も働くため,分子量が同程度の無極性分子よりファンデル ワールス力が強くなる
②水素結合とは
F−H 、O−H 、N−H の結合を分子内にもつ分子のこと。
水素原子に対して、フッ素、酸素、窒素は電気陰性度が高く電子を引きつけるため、電子がない水素は他の電子を引きつける力が強くなる(ファンデルワールス力よりも強い)。
分子結晶の構造
金属の面心立方格子のような構造(4粒)をもつものがある。
分子間力は弱いため,分子結晶はやわらかく,融点が低い。
特にヨウ素 I2,二酸化炭素 CO2 ,ナフタレン C10H8 のように昇華性をもつものがある。
氷の結晶構造
正四面体のすき間の多い構造
つまり、氷(固体)のほうが水(液体)より体積が大きく,密度が小さい。
そのスキマが多い理由は、水素結合。
-120x120.jpg)
.jpg)
配位数、粒子数、原子半径、充填率、密度.jpg)
密度の計算問題.jpg)
配位数、粒子数、原子半径、充填率、密度.jpg)
密度の計算問題.jpg)
配位数、粒子数、原子半径、充填率.jpg)
.jpg)
.jpg)
.jpg)

