【大学入試】化学~目次一覧~
第1編 物質の状態
粒子の結合と結晶の構造
物質の状態変化
気体
溶液
第2編 物質の変化
化学反応とエネルギー
電池と電気分解
化学反応の速さ・化学平衡
第3編 無機物質
無機物質(総論)
非金属元素 ⇒現在はここのページ
金属元素Ⅰ 典型元素
金属元素Ⅱ 遷移元素
第4編 有機化合物
有機化合物の分類と分析
脂肪族炭化水素
アルコールと関連化合物
芳香族化合物
第5編 高分子化合物
天然高分子化合物
合成高分子化合物
計17章ほど
化学《非金属元素》重要語句と典型問題まとめ・総チェック
ハロゲン
ハロゲンの単体は全て二原子分子で、無極性である。
フッ素F2(原子番号:9)
常温常圧の状態で、気体
淡黄色
塩素Cl2(原子番号:17)
常温常圧の状態で、気体
黄緑色
臭素Br2(原子番号:35)
常温常圧の状態で、液体
赤褐色
ヨウ素I2(原子番号:53)
常温常圧の状態で、固体
黒紫色
★酸化力(電子を奪う力)
フッ素F2>塩素Cl2>臭素Br2>ヨウ素I2
例 2KBr + Cl2 → 2KCl + Br2
塩素の方が、臭素よりも酸化力(電子を奪う力)が強いので、
塩素が臭化物イオン(Br-)から電子を奪って、塩化物イオン(Cl-)となる。
逆反応は起こらない。
★水との反応
フッ素F2
激しく反応し酸素発生。
酸化力(電子を奪う力)が強いため、フッ素は水から電子を奪い、フッ化水素(HF)となる。
*酸素が発生ということは、酸素が酸化(-2 → 0 電子が奪われている)されており、通常、酸化力の強い酸素すらも、フッ素によって酸化されていることを意味している。
2F2 + 2H2O → 4HF + O2
塩素Cl2
一部反応し溶解する
Cl2 + H2O ⇔ HCl + HClO(次亜塩素酸:殺菌漂白作用あり)
臭素Br2
わずかに反応し溶解する
Br2 + H2O ⇔ HBr + HBrO
ヨウ素I2
反応せず、溶解しない。
*ヨウ化カリウム水溶液(KIaq)には溶ける。I2 + I- → I3-(三ヨウ化物イオン、褐色)
ハロゲン化水素
フッ化水素HF:結合力の強い水素結合あり
塩化水素HCl
臭化水素HBr
ヨウ化水素HI
★沸点について
沸点は、分子量の大きい分子ほど沸点が高くなるはずである。
しかし、フッ化水素HFのみ、結合力の強い水素結合を生じているので、沸点が1番高くなっている。
✕ フッ化水素HF <塩化水素HCl <臭化水素HBr <ヨウ化水素HI
〇 塩化水素HCl <臭化水素HBr <ヨウ化水素HI <フッ化水素HF
★酸の強弱
塩酸:塩化水素+水の混合物
フッ化水素HF(弱酸)<塩化水素HCl(強酸)<臭化水素HBr<ヨウ化水素HI
*フッ化水素HFのみが弱酸の理由:結合力の強い水素結合を生じているので、電離しにくい
★その他の性質
フッ化水素HF:ガラス(SiO2)と反応するため,ポリエチレン容器に保存
塩化水素HCl:NH3 と反応して白煙・固体 (NH4Cl) を生じる
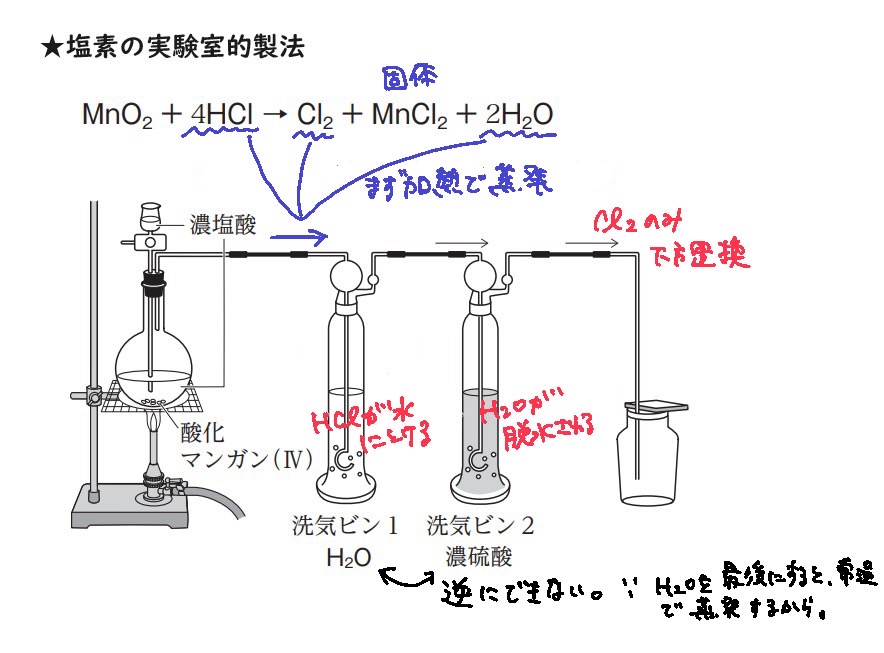
塩素の実験室的製法
MnO2 + 4HCl(液体だが揮発性あり) → Cl2(気体) + MnCl2(固体) + 2H2O(水蒸気で気体)
MnO2:弱い酸化剤なので、加熱が必要
加熱をすると、①HCl、②H2O、③Cl2の3つが試験管を通って移動してくる
まず洗気ビン1に水を入れておくと、HClが全て電離(溶け)してくれる
次に洗気ビン2に濃硫酸を入れておくと、脱水作用によりH2Oが吸収される
最後に下方置換によって出てくるのがCl2
酸素
同素体とは
同じ元素からなる単体のこと。
例 酸素とオゾン
原子番号が等しく、中性子の数が異なる原子のこと。(イメージ:同じ人だが体重が重くなったもの)
例 質量数が16の酸素原子には質量数が18の酸素原子がある割合でまざっている。
★酸素O2 とオゾンO3 の違い
色と匂いについて
酸素:無色、無臭
オゾン:淡青色、特異臭
酸化力(電子を奪う力)について
酸素:弱い
オゾン:強い。ヨウ化カリウム(KI)デンプン紙を青変
製法について
酸素:過酸化水素H2O2 に酸化マンガンⅣMnO2(触媒)を加える または、 塩素酸カリウムKClO3 に酸化マンガンⅣMnO2(触媒)を加える
オゾン:O2 中で紫外線照射,または無声放電 3O2 → 2O3
酸化物の定義、酸化物の種類
酸化物とは
酸素とそれより電気陰性度が小さい元素からなる化合物のこと。
化学式で『~O』の形になる
例① CO2 『非金属元素+O』の形
二酸化炭素は、酸性酸化物(非金属元素の酸化物)の例である。
酸性酸化物とは、水と反応して酸(オキソ酸)を生じたり,塩基と反応して塩を生じるものをさす。
二酸化炭素の場合、水と反応して、炭酸(弱酸性)を生じ、炭酸は塩基と反応できる。
CO2 + H2O → H2CO3
例② CaO 『金属元素+O』の形
酸化カルシウムは、塩基性酸化物(金属元素の酸化物)の例である。
塩基性酸化物とは、水と反応して塩基(水酸化物)を生じたり,酸と反応して塩を生じるものをさす。
酸化カルシウムの場合、水と反応して水酸化カルシウム(強塩基)を生じ、水酸化カルシウムは酸と反応する。
CaO + H2O → Ca(OH)2
例③ Al2O3 『両生金属+O』の形
酸化アルミニウムは、両性酸化物(両性金属の酸化物)の例である。
ここで、両生金属とは、両性金属:Al,Zn,Sn,Pb (暗記:ああすんなり)などをさす。
両性酸化物とは、 酸とも強塩基とも反応する酸化物をいう。
酸化アルミニウムは、塩酸(強酸)と反応できるし、Al2O3 + 6HCl → 2AlCl3 + 3H2O
水酸化ナトリウム(強塩基)とも反応できる。Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
オキソ酸とは
オキソ酸とは
例 硫酸H2SO4 ・硝酸HNO3 ・ 過塩素酸HClO4 など
酸素原子をもつ酸(酸性の物質)のこと。
酸性酸化物と水の反応によって生じる。
酸性酸化物(非金属元素の酸化物で、水と反応して酸ができるもの)が水と反応して生じる酸は、ほとんどがオキソ酸である。
例 酸性酸化物+水⇒オキソ酸
例 CO2 + H2O → H2CO3
例 SO3 + H2O → H2SO
酸の強弱
同一元素のオキソ酸の酸の強弱は、中心原子の酸化数が大きいものほど酸性が強い。
例 硫酸と亜硫酸なら、真ん中の硫黄原子の酸化数が、硫酸のSは+6、亜硫酸のSは+4なので、硫酸の方が酸性が強い。
硫酸H2SO4( 強酸 )>亜硫酸H2SO3( 弱酸 )
硫黄
硫黄の単体(同素体について)
斜方硫黄
S8(黄色の王冠型分子 )
常温で安定
二硫化炭素 CS2 に溶解
単斜硫黄
S8 (黄色の王冠型分子)
高温で安定
斜方硫黄と比べて密度が小さい (高温で熱運動が激しく,分子間距離が大きくなり体積が増加するため)
ゴム状硫黄 Sx
弾性をもつ無定形固体
不安定
硫黄の融解液を加熱し,水中に流し込んで急冷すると得られる
硫黄の化合物(濃硫酸・希硫酸)
濃硫酸
★濃硫酸H2SO4とは
濃度が約 98%の硫酸水溶液のこと。
水が2%しかないため、ほぼ電離していない
→濃硫酸は、酸としてH+を与えたいが、与える対象である水が少ない
→水を吸収する(吸湿性)
→水がなくても水を作りだす(脱水性)
※脱水性の例
ショ糖の炭化
C12H22O11 → 11H2O + 12C
★濃硫酸の構造:水素結合
→粘性、密度が大きい、沸点が高い(不揮発性)液体という性質を持つ
★濃硫酸の溶解熱が大きい
そもそも溶解熱とは水に解けるときの熱のこと。
★濃硫酸の工業的製法
二酸化硫黄SO2 を原料とした接触法
材料である二酸化硫黄SO2 の入手方法
①黄鉄鋼 FeS2 を燃焼
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
②石油などに含まれる硫黄を燃焼
S+O2 →SO2
接触法の流れ
①二酸化硫黄から三酸化硫黄をつくる
※活性化エネルギーを低くするために触媒に酸化バナジウム(V)V2O5 を使用
2SO2 + O2 → 2SO3
②三酸化硫黄と水(希硫酸の水)で硫酸へ
SO3 + H2O → H2SO4
※水と化合させるときに、水の上から三酸化硫黄を滴下するのはNG。なぜなら、濃硫酸はできるが発熱により飛び散るから。
※水との化合のさせ方:濃硫酸と三酸化硫黄の混合液(発煙硫酸と呼ばれる)に、希硫酸(水+H2SO4)を滴下することで、希硫酸の水と反応させる。
希硫酸
★希硫酸H2SO4とは
濃硫酸を水で薄めたものをさす。
※希硫酸は、十分な水が存在するため電離しており、強酸性である。
※濃硫酸はそもそも水にほぼ電離していないため、酸性というより、酸化剤として働く。
濃硫酸の酸化剤の式 H2SO4 + 2e-+ 2H+→ SO2 + 2H2O
★希硫酸のつくり方
濃硫酸に水を加えるだけ。
しかし、濃硫酸の溶解熱が大きいという性質により、濃硫酸の上から水を滴下すると飛散してしまうため危険。
水の上から濃硫酸を加えてつくる。
窒素
窒素の化合物(硝酸HNO3)
★硝酸HNO3とは
無色の液体
強酸
酸化剤、酸化剤の式欲しい
揮発性(沸点が低く常温で蒸発)あり
感光性
光や熱で分解が起こり,二酸化窒素NO2 に変化してしまう(無色から褐色に変化)。
そのため保存方法は、硝酸は褐色ビンに入れ,冷暗所に保存する。
4HNO3 → 4NO2(赤褐色) + 2H2O + O2
★硝酸の作成方法
揮発性の酸遊離反応を利用。
硝酸ナトリウムに濃硫酸を加えて加熱
NaNO3 + H2SO4 → HNO3 + NaHSO4
★硝酸の工業的製法
アンモニアNH3 を原料としたオストワルト法
原料であるアンモニアNH3 は、ハー バー・ボッシュ法(N2 と H2 を1:3で混合した気体を,Fe3O4 触媒下で高温高圧で反応させる)で合成したものを使用する。
N2 +3H2 →2NH3
オストワルト法の流れ
①白金 Pt 触媒存在下で アンモニアNH3 を 800°Cで燃焼させて、一酸化窒素を得る。
※ Pt 触媒が無いと N2 に変化
4NH3 + 5O2 → 4NO + 6H2O
②一酸化窒素NO (無色)を空気と接触させて 二酸化窒素NO2 (黄褐色)にする。 2NO + O2 → 2NO2
③二酸化窒素を温水に溶かして 硝酸HNO3 にする。
※副産物の 一酸化窒素NO は②へ再利用
3NO2 + H2O → 2HNO3 + NO
(①の式+②×3+③×2)÷4より
最終的な反応式は
NH3 + 2O2 → HNO3 + H2O
※NO は再利用するため,最終的な式からは消えている。
※原料のNH3 と生成するHNO3 のmol比が1:1になっており、効率の良い生成方法とわかる。
リン
リンの単体(同素体)
★黄リン(P4)
構造・P原子の配列が正四面体の形
淡黄色の固体(純度の高いものは白色)
空気中で自然発火(→水中保存)
猛毒
湿った空気中で青白く光る(リン光)
二硫化炭素 CS2 に溶解
黄リンの作り方
自然界で、リン鉱石(主成分 リン酸カルシウムCa3(PO4)2)にケイ砂 SiO2 とコークス C を加えて強熱すると得られる。
★赤リン(P)
構造・黄リンの正四面体が崩れた形
暗赤色の粉末
マッチの側薬に利用されている
赤リンの作り方
空気を遮断して黄リンを約 250°Cに加熱すると得られる (空気と接すると十酸化四リン P4O10 に変化)
リンの化合物(十酸化四リン、リン酸、過リン酸石灰)
★十酸化四リン P4O10
作り方・リンの単体を空気中で燃焼させると生じる。
4P + 5O2 → P4O10
吸湿性・脱水性が強い(乾燥剤として使用)
★リン酸 (H3PO4)
作り方・十酸化四リン P4O10に水を加えて加熱する。
P4O10 + 6H2O → 4H3PO4
中くらいの強さの酸(弱酸の中では強い)
3段階で電離
H3PO4 ⇄H+ + H2PO4 −
H2PO4 − ⇄H+ + HPO4 2−
HPO4 2− ⇄H+ + PO4 3−
★過リン酸石灰
過リン酸石灰とは、リン鉱石 ( 主成分 Ca3(PO4)2)に適量の硫酸を反応させると得られる肥料 のこと。
リン酸二水素カルシウム Ca(H2PO4)2 と硫酸カルシウム CaSO4 の混合物をさす。
Ca3(PO4)2 + 2H2SO4 →Ca(H2PO4)2 + 2CaSO4
※リンP は肥料の三要素(窒素、カリウム、リン)の一つで,根の生育に必要。
ケイ素の単体
以上で、化学《非金属元素》が終了です。
お疲れ様でした。
次の高校化学の単元はコチラ
⇒編集中
-120x120.jpg)
.jpg)
の色まとめ.jpg)
まとめ.jpg)
.jpg)